
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Влияние общих (одноименных) и посторонних ионов.
Степень электролитической диссоциации вещества зависит не только от его концентрации в растворе, но и от присутствия в растворе других электролитов. Степень диссоциации слабого электролита понижается при введении в раствор сильного электролита, содержащего одноименный (т.е. общий) ион с исходным электролитом. Влияние одноименного иона легко объясняется с позиций закона ЗДМ.
Рассмотрим равновесие в растворе аммиака:
Константу равновесия этой реакции можно представить уравнением
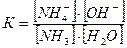
Если к раствору аммиака прилить сильный электролит, содержащий одноименные ионы, например, хлорид или нитрат аммония, то концентрация катионов NH4+ повысится во много раз. Благодаря этому числитель уравнения возрастает и величина дроби станет больше константы диссоциации. Нарушенное таким образом равновесие будет восстанавливаться в результате соединения ионов NH4+ и OH- в недиссоциированные молекулы NH4OH.
Следовательно, степень диссоциации слабого электролита понижается при введении в раствор какого-либо сильного электролита, содержащего одноименный с ним ион.
В рассмотренном случае концентрация ионов OH- понизится и раствор аммиака в присутствии NH4Cl или NH4NO3 будет вести себя как еще более слабое основание. Для понижения концентрации ионов H+ в растворе уксусной кислоты достаточно прибавить к нему немного соли этой кислоты, например, ацетата натрия, содержащей одноименный ион CH3COO-.
В аналитической химии иногда необходимо поддерживать в исследуемом растворе определенную, приблизительно постоянную концентрацию ионов  , которая не должна изменяться при хранении, разбавлении раствора, добавлении к нему небольших количеств сильной кислоты или щелочи.
, которая не должна изменяться при хранении, разбавлении раствора, добавлении к нему небольших количеств сильной кислоты или щелочи.
Свойства некоторых растворов сохранять практически постоянную концентрацию ионов водорода при добавлении небольших количеств кислоты, щелочи, а также при разбавлении, называют буферным действием, а растворы, которые обладают таким свойством – буферными растворами. Они представляют собой смеси электролитов, содержащие одноименные ионы. Например, ацетатный буферный раствор – смесь уксусной кислоты и ацетата натрия 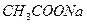 , аммонийный буферный раствор – смесь
, аммонийный буферный раствор – смесь  и
и  .
.
Дата добавления: 2015-01-29; просмотров: 340; Мы поможем в написании вашей работы!; Нарушение авторских прав |