
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Гетерогенные равновесия с участием малорастворимых ионных соединений. Произведение растворимости.
Произведение растворимости. Применим закон действующих масс кгетерогенной системе — насыщенному раствору малорастворимогосоединения, находящегося в равновесии с твердой фазой. Еслималорастворимое соединение распадется на катионы и анионы А ", то между твердой фазой и раствором установится равновесие
. Это равновесия в гетерогенных системах которое устанавливает лишь при растворении труднорастворимых солей (выпадающих в осадок). Если малорастворимое соединение погрузить в воду, то между твердой фазой и насыщенным раствором этого в-ваустанавливается динамическое равновесие.применяя к этому равновесию закон PLV и учитывая что соль малорастворима и знаменатель дроби фактически постоянная величина, запишем
Чем меньше Пр тем треднее осуществить растворимость. Пр можно рассматривать как меру растворимости осадка электролита. Для бинарного электролита AgCl его растворимость определяется равновесными концентрациями серебра и хлора. Поэтому растворимость этой соли (РAgCl=[Ag+]=[Cl-]=корень из 1,8*10-10=1,33*10-5. То есть такое кол-во моль в литре соли находятся в состоянии полной диссоциации (или в жидкой фазе насыщенного р-ра AgCl содержится такое число ионов. Зная Пр можно предвидеть возможность перехода того или иного в-ва в осадок. Если произведение концентрации ионов малорастворимого соединения в растворе меньше его Пр, то осадок не образуется. Если это произведение больше Пр, то осадок выпадает. Если равно – насыщенный раствор.
Смещение равновесий в растворах амфотерных электролитов.
Амфотерные электролиты (амфолиты) – гидроксиды металлов, способные к диссоциации как по основному, так и по кислотному механизму. К ним относятся: ZnOH2, хром OH3, BeOH2, SnOH2, AgOH2, ЗиЩР2 и др. при диссоциации этих гидроксидов могут устанавливаться 2 типа ионных равновесий. Смещение этих равновесий может происходить как при добавлении кислот так и при добавлении оснований. Напр:
Zn2++2OH-+2H20 стрелки Zn(OH)2+2H2O стрелки [Zn(OH)4]2+2H+
1. Zn(OH)2 + 2 HClà ZnCl2+2H2O
Zn(OH)2+2H+2Clà Zn+2Cl+2H2O
Zn(OH)2+2HàZn+2H2O
Zn(OH)2+NaOHà Na[Zn(OH)4]
Zn(OH)2+2Na+2OHà2Na+[Zn(OH)4]-2
Zn(OH)2+2OHà[Zn(OH)4]
Растворы комплексных соединений ( на 4)
Большинство комплексных солей – хорошие электролиты, но всегда диссоциируют на первую стадию сильную, внешнюю сферу и сам комплекс.
2-ая стадия – диссоциация комплекса как слабого электролита. Напишем диссоциацию комплексной соли: гексоцианоферрат(III) калия.
I K+3[Fe(CN)6]3-стрелки 3K+[Fe(CN)6]
II [Fe(CN)6]стрелки Fe+6CN
Написать выражение для конастанты..
K=([Fe3+]*[CN-]6)\[[Fe(CN)6]]3- (Кн)
Кн=(aFe3+*aCN6)\a[Fe(CN)6]3-
Чем меньше значение Кн, тем стабильнее или прочнее сам комплекс или наоборот – чем болье значение Кн тем сильнее его способность к диссоциации.
Реакции ионного обмена
Обязательным условием протекания реацкии между электролитами до конца является удаление из раствора тех или иных ионов, в следствие образования слабого электролита,осадка или газа. Для правильного отражения сущности и механизма реакции ионного обмена все уравнения записывают в ионно молекулярной форме. При этом сильные электролиты в виде ионов, а слабые (средней силы) малорастворимые - в виде целые молекул. Для этого записывается 3 уравнения: 1-ое молекулярное, 2-ое развернутое (молекулярное) 3-е краткое (сокращенное ионно-молекулярное) напр:
1. BaCl2 + Na2SO4àBaSo4 + 2NaCl
2. Ba+2Cl+2Na+SO4àBaSO4+ 2 Na + 2 Cl
3. Ba + SO4àBaSO4 (белый осадок)
Реакции нейтрализации H+ +OH- àH2O протекает в результате связывания ионов сильных электролитов с образованием воды(слабого электролита). Направления реакции ионного обмена обратимы. Направления реакций определяют по свободной энергии Гиббса. Константу равновесия математически рассчитывают через константы диссоциации слабых элентов.
Произведение растворимости (ПР, Ksp) — произведение концентраций ионов малорастворимого электролита в его насыщенном растворе при постоянной температуре и давлении. Произведение растворимости — величина постоянная.
При постоянной температуре в насыщенных водных растворах малорастворимых электролитов устанавливается равновесие между твердым веществом и ионами, образующими это вещество. Например, в случае для CaCO3 это равновесие можно записать в виде:

Константа этого равновесия рассчитывается по уравнению:
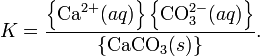
В приближении идеального раствора с учётом того, что активность чистого компонента равна единице, уравнение упрощается до выражения:

Константа равновесия такого процесса называется произведением растворимости.
В общем виде, произведение растворимости для вещества с формулой AmBn, которое диссоциирует на m катионов An+ и n анионов Bm-, рассчитывается по уравнению:

где [An+] и [Bm-] — равновесные молярные концентрации ионов, образующихся при электролитической диссоциации.
Из произведений растворимости можно рассчитать концентрации катионов и анионов в растворе малорастворимого электролита. Значения произведений растворимости приведены в справочниках.
Дата добавления: 2015-01-29; просмотров: 471; Мы поможем в написании вашей работы!; Нарушение авторских прав |