
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Слабые электролиты. Константа диссоциации
Диссоциация слабых электролитов протекает обратимо и к нему можно применить закон действующих масс. Так, для процесса диссоциации уксусной кислоты
СH3COOH⟺CH3COO‒ + H+
константа равновесия КС будет равна
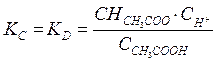 (4.14)
(4.14)
Константа равновесия процесса диссоциации и называется константой диссоциации kD.
Константа диссоциации зависит от природы диссоциирующего вещества, растворителя и не зависит от концентрации. С увеличением температуры КD уменьшается.
Согласно принципу Ле Шателье температурная зависимость kD указывает на то, что процесс диссоциации является экзотермическим.
Чем меньше kD, тем слабее диссоциирует электролит и тем устойчивее его молекулы. Сильные электролиты диссоциируют полностью, поэтому kD для них теряет смысл. Для сильных электролитов КD ³ 10-2, для слабых КD £ 10-5.
Количество ионов в растворах сильных электролитов больше чем в растворах слабых той же концентрации.
Константа диссоциации указывает на прочность молекул слабых электролитов в данном растворе. Чем меньше константа диссоциации в данном растворителе, тем слабее диссоциирует электролит и тем, следовательно, устойчивее его молекулы. Учитывая, что степень диссоциации в отличие от константы диссоциации изменяется с концентрацией раствора, необходимо выяснить связь между степенью диссоциации электролита и концентрацией его в растворе. Для этого рассмотрим реакцию диссоциации:
AmBn⟺mA++nB-,
где m, n-стехиометрические коэффициенты (индексы).
Если обозначить концентрации катионов А+ через СA+ , а анионов В- - через СB- концентрацию недиссоциированного остатка AmВn - через СAmВn , то, применяя к реакции закон действующих масс, получим константу диссоциации электролита
 (4.15)
(4.15)
Если исходная концентрация или брутто-концентрация соединения AmВn, равна С0, то, очевидно
СA+ = m α С0 (4.16)
СB- = n α С0 (4.17)
СAmВn = С0 (1 – α ) (4.18)
Подставляя значения СA+, СB- и СAmВn из (4.16) - (4.18) в уравнение (4.15), будем иметь
 (4.19)
(4.19)
или
 (4.20)
(4.20)
Для бинарного электролита АВ ( m =1, n =1) уравнение примет вид
 (4.21)
(4.21)
Это обобщенное уравнение закона разведения Оствальда.
[AD]
Для растворов слабых электролитов, у которых степень диссоциации << 1, уравнение можно упростить, считая, что разность (1 – α ) » 1. Тогда
 (4.22)
(4.22)
Степень  возрастает при разведении раствора. Уравнение показывает зависимость
возрастает при разведении раствора. Уравнение показывает зависимость  от концентрации. С увеличением концентрации -
от концентрации. С увеличением концентрации -  уменьшается.
уменьшается.
73. Зависимость степени диссоциации от природы растворённого электролита и растворителя, концентрации, температуры, присутствия посторонних электролитов.
Дата добавления: 2015-01-29; просмотров: 363; Мы поможем в написании вашей работы!; Нарушение авторских прав |