
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
ТЕОРЕТИЧЕСКОЕ ОБОСНОВАНИЕ РАБОТЫ. Идеальными принято считать газы, подчиняющиеся уравнению Клапейрона (pv = RT).
Идеальными принято считать газы, подчиняющиеся уравнению Клапейрона (pv = RT).
Закон Бойля-Мариотта. При постоянной температуре (t = const) произведение абсолютного давления и удельного объема идеального газа сохраняет неизменную величину (pv = const), т. е. произведение абсолютного давления и удельного объема зависит только лишь от температуры газа

Или

откуда при t= const имеем
 (96)
(96)
Закон Гей-Люссака. При постоянном давлении (р = const) объем идеального газа изменяется прямо пропорционально повышению температуры.
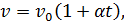
где v – удельный объем газа при температуре t°C и давлении р;
v0 – удельный объем газа при температуре t = 0°C и том же давлении р;
a – температурный коэффициент объемного расширения идеальных газов при 0°С, сохраняющий одно и то же значение при всех давлениях и одинаковый для всех идеальных газов,
 (97)
(97)
Таким образом, содержание закона Гей-Люссака сводится к следующему утверждению: объемное расширение идеальных газов при изменении температуры и при р=const имеет линейный характер для всех идеальных газов, а температурный коэффициент объемного расширения a является универсальной постоянной идеальных газов.
Сопоставление законов Бойля–Мариотта и Гей-Люссака приводит к уравнению состояния идеальных газов (уравнению Б. Клапейрона,). Действительно, подставляя выражение удельного объема идеального газа v0 при температуре 0°С и любом давлении р в выражение удельного объема этого газа при любой температуре t и том же давлении р, находим
 (98)
(98)
где v – удельный объем газа;
р – абсолютное давление газа;
R – удельная газовая постоянная идеального газа;
Т – абсолютная температура идеального газа.
Физический смысл удельной газовой постоянной идеального газа R можно проследить на основе следующего рассуждения. Для начального и конечного состояния газа можно записать для процесса p = const (неизменное давление)

и

Следовательно, удельная газовая постоянная идеального газа R – это удельная работа газа в процессе p = const при изменении температуры на один градус.
3акон А. Авогадро. Объем одного моля идеального газа v не зависит от природы газа и вполне определяется давлением и температурой вещества (р, t). На этом основании можно заключить, что объемы молей разных газов, взятых при одинаковых давлениях и температурах, равны между •собой.
Если v – удельный объем газа, а m– молярная масса, то объем моля (мольный объем) равен v = mv. При равных давлениях и температурах для разных газов имеем
 (99)
(99)
Моль – это количество вещества в граммах, численно равное его молярной массе, а киломоль – количество вещества в килограммах, численно равное его молярной массе. Так, например, киломоль кислорода О2 равен 32 кг, киломоль углекислого газа СО2 – 44 кг и т. д. (1 киломоль = 1000 моль). Подставляя в уравнение значение удельного объема v, определяемого из уравнения Клапейрона, находим
 (100)
(100)
Так как удельный мольный объем газа v зависит в общем случае только от давления и температуры, то произведение mR в уравнении есть величина одинаковая для всех газов и поэтому называется универсальной газовой постоянной. Обозначается она R. Ее физический смысл тот же, что и удельной газовой постоянной R в уравнении
 (101)
(101)
Из данного уравнения следует, что удельные газовые постоянные отдельных газов R определяются через их молярные массы. Например, для азота (N2=28) удельная газовая постоянная
 (102)
(102)
Следовательно, в уравнении Клапейрона индивидуальные свойства каждого газа проявляются в значении его удельной газовой постоянной R.
Уравнение Клапейрона может быть представлено в следующих видах. Для 1 кг газа

для М (кг) газа с учетом того, что Мv = V
 (103)
(103)
где  – количество вещества в молях,
– количество вещества в молях,
для одного кмоля газа
 (104)
(104)
Уравнение для 1 кмоля вещества, выведенное великим русским ученым Д. И. Менделеевым, часто называется уравнением Менделеева или Менделеева – Клапейрона.
Значение мольного объема идеальных газов в нормальных физических условиях (t= 0°С и р= 101,1 кПа) принимается равным 22,414 м3/кмоль~22,4 м3/кмоль
 (105)
(105)
Дата добавления: 2015-04-18; просмотров: 327; Мы поможем в написании вашей работы!; Нарушение авторских прав |