
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
ТЕОРЕТИЧЕСКОЕ ОБОСНОВАНИЕ РАБОТЫ
Исследование термодинамических процессов проводится по следующим направлениям с целью:
а) установления закономерности изменения состояния рабочего тела в процессе;
б) выявления особенности превращения энергии в процессе.
При этом выводится уравнение процесса и устанавливается соотношение между параметрами состояния, а также определяется количество теплоты, сообщаемой рабочему телу, изменение его внутренней энергии и совершаемая работа.
Среди всего многообразия различных процессов имеются некоторые частные случаи, когда на условия протекания накладываются какие-либо ограничения. Таких процессов четыре:
процесс, протекающий при постоянном объеме рабочего тела (изохорный процесс);
процесс, протекающий при постоянном давлении рабочего тела (изобарный процесс);
процесс, протекающий при постоянной температуре рабочего тела (изотермический процесс);
процесс, протекающий без теплообмена между рабочим телом и внешней средой (изоэнтальпийный или адиабатный процесс).
Затем рассматривают обобщающий (политропный) процесс, по отношению к которому перечисленные выше процессы являются частными случаями. Рассмотрим эти процессы.
Изохорный процесс. Примером такого процесса может быть охлаждение или нагревание газа в герметичном сосуде. Уравнение процесса имеет вид: v = const.
Графическое изображение изохорного процесса в координатах р-v представляет собой отрезок прямой, параллельной оси ординат (рис. 16,а).

Рисунок 16 - Основные термодинамические процессы в p-v-диаграмме
При нагревании газа его давление и температура возрастают, при охлаждении – уменьшаются. Графическое изображение этого процесса называют изохорой.
Соотношение между параметрами находят из уравнения состояния в начале и конце процесса:
P\V = RT2. (112)
Это закон Шарля, который показывает, что давление изменяется прямо пропорционально абсолютной температуре газа.
Так как объем газа не изменяется, то никакой работы в процессе не совершается.
Таким образом, в изохорном процессе вся подведенная (или отведенная) теплота идет на увеличение (или уменьшение) внутренней энергии.
Изобарный процесс. Так называется процесс изменения состояния газа, который осуществляется при постоянном давлении. Например, процесс нагревания воздуха в помещении.
Уравнение процесса в Р-v-диаграмме р = const, а графическое изображение – отрезок прямой, параллельный оси абсцисс, который называется изобарой (рис. 16,б).
Из уравнения состояния идеального газа следует:
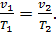 (113)
(113)
Это закон Гей-Люссака, который свидетельствует о том, что в изобарном процессе объем газа изменяется прямо пропорционально его абсолютной температуре.
В этом процессе часть теплоты, подведенной к рабочему телу, расходуется на изменение внутренней энергии тела, а другая часть – на совершение работы.
Изотермический процесс. Это процесс изменения состояния газа, который происходит при постоянной температуре. Уравнение этого процесса для идеального газа является выражением закона Бойля-Мариотта и имеет вид pv = const. Графическое изображение этого процесса в v-диаграмме имеет вид равнобокой гиперболы, которая называется изотермой. Процесс 1-2 отображает изотермическое расширение газа, которое возможно лишь при подводе теплоты, процесс 2-1 –изотермическое сжатие газа.
Из уравнения состояния идеального газа следует
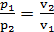 (114)
(114)
т.е. отношение абсолютных давлений обратно пропорционально отношению объемов.
Так как температура газа в процессе не изменяется (dt = 0), то внутренняя энергия также постоянна (и = const), т.е. Du = 0.
Таким образом, вся теплота, подведенная к газу в изотермическом процессе, расходуется на совершение механической работы.
Адиабатный процесс. Адиабатными называются процессы изменения состояния рабочего тела, осуществленные без подвода и отвода теплоты, т.е. dq = 0. Это необходимое и достаточное условие данного процесса. При этом, очевидно, что и q = 0. Но не всякий процесс, для которого q = 0, будет адиабатным, так как возможны процессы, в одной части которых теплота подводится, а в другой – такое же количество теплоты отводится. Поэтому q = 0 – условие необходимое, но недостаточное.
Практически адиабатный процесс может происходить при расширении или сжатии газа в цилиндре, выполненном из нетеплопроводного материала, или в процессе, который протекает настолько быстро, что теплообмен с опережающей средой не успевает произойти.
Адиабата в р-v-диаграмме изображается неравнобокой гиперболой, а так как к > 1, то гиперболой более крутой, чем изотерма (см. рис. 16,г).
Политропный процесс. Эти процессы являются общими для всего многообразия действенных процессов измерения состояния рабочего тела. В политропных процессах происходит изменение всех параметров, тогда как в рассмотренных выше один из параметров оставался неизменным. Вид кривой, изображающей какой-либо конкретный процесс, отличается от приведенных ранее, а сама кривая называется политропной.
Общее уравнение политропных процессов имеет вид pvn = const,
где и – постоянная для данного процесса величина, которая называется показателем политропы и может принимать значение от 0 до ±¥.
Рассмотренные выше термодинамические процессы являются частными случаями политропных процессов.
Дата добавления: 2015-04-18; просмотров: 349; Мы поможем в написании вашей работы!; Нарушение авторских прав |