
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Кристаллизация сульфата кальция и условия образования крупнокристаллического осадка.
Кристаллический СаSO4 может тормозить процесс разложения апатита H2SO4. Мелкие кристаллы отлагаются на поверхности зерён апатита и препятствуют проникновению серной к-ты. Чем крупнее кристаллы СаSO4, тем более рыхлый проницаемый слой образуются на зёрнах апатита. Мелкие кристаллы выпадают в тех случаях, когда кристаллизация идёт с большой скоростью и появляется много центров кристаллизации (зародышей кристалла). Чем выше степень пересыщения р-ра, тем больше скорость кристаллизации. Степень пересыщения р-ра определяется и соотношения:
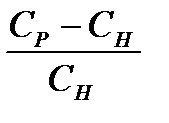 (8)
(8)
где Ср – концентрация пересыщ. р-ра; Сн – концентрация насыщ. р-ра.
Мелкие игольчатые кристаллы СаSO4, образование к-ых следует избегать имеют длину 5-10 мкм и ширину 1-3 мкм. В ходе экстракции необходимо создать условия для образования крупных кристаллов СаSO4. Например. Оптимальные размеры кристаллов СаSO4 *2 Н2О следующие: длина 200-400 мкм; ширина 100-200 мкм. Кроме этого, крупнокристаллический ос-к легко отделяется от продукционной H3PO4 фильтрацией и промывается от остатков к-ты небольшим количеством воды. Основным условием образования крупнокристаллического осадка является кристаллизация СаSO4 из малопересыщенных растворов, когда скорость образования зародышей низкая. На практике малое пересыщение достигается за счёт непрерывного ведения процесса, увеличения времени экстракции( реакционного объёма), применения внешней и внутренней циркуляции пульпы. В этих условиях новые зародыши почти не возникают и поддерживается практически постоянная степень пересыщения (0,5-0,7). Именно созданием условий крупных кристаллов СаSO4, объясняется повышение времени процесса экстракции до 5-8 ч, хотя достигается высокая степень кислотного разложения за 1-1,5 ч. Другим важным условием является поддержание в жидкой фазе неб. концентрации свободной серной к-ты (1,5-2,5% SO3 – в дегидратном процессе и 1,0-1,5% SO3 – полугидратном процессе).
Избыток к-ты повышает растворимость СаSO4 и следовательно снижает степень пересыщения р-ра. Большое влияние на форму и размеры кристалла СаSO4 оказывают примеси. В присутствии примеси Н2SiF6 , соединений Аl и Fe , резко укрупняются и из удлиненных кристаллы игловатых превращаются в более короткие и широкие. Так же необходимым условием кристаллизации является проведение процесса при постоянной температуре. Кристаллизация дигидрата СаSO4 сопровождается совиестеым осаждением фосфатных ионов НРО4 2-, к-ые внедряются в кристалличекую решётку Гиббса. Это приводит к потерям Р2О5 и затрудняет дальнейшее использование СаSO4.
Дата добавления: 2015-04-18; просмотров: 447; Мы поможем в написании вашей работы!; Нарушение авторских прав |