
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Основные стадии процесса окисления аммиака до оксида азота(2), как гетерогенно-каталитического ХТП.
Стадии гетерог катализа:1) дифф-я исх в-в из ядра потока к пов-ти Kt, 2) адсорбция исх в-в на пов-ти Kt, 3) диф-я исх в-в в порах зерна Kt,4) хим р-я. 5) перегрупп-вка атомов поверх-ого соед-я с образованием продуктов р-ции, 6) дифф-я прод-в р-ции с внутренней пов-ти катализ-ра к его внешн пов-ти, 7) диф-я продуктов р-ции в ядро потока. 4NH3 + 5O2 = 4NO + 6H2O, -904.
Общепр-ым Kt –ом явл-ся Pt.Процесс конт-ого окисл NH3-я начин со стадии активированной адсорбции на пов-и Kt с образов-м промеж соедин O – Kt – O, после чего происх активир-ая адсорбция NH3, требующая меньшей энергии актив. В процессе обр-ся переходный комплекс О – К – О - NH3. Согласно адсорбционно-химической теории кат-за, процесс окисл-я предст-ся след-им образом. Кислород и NH3 диффундируют из газ-й смеси к пов-и Kt. При стех-ом соотнош-и О2: NH3=5:4 скорость процесса опред-я дифф-й кислорода и NH3 к пов-и Kt. Вследствие выс-й темп-ы конт-я ковалентная связь м-у атомами этих газов осл-на, в рез-е чего обр-я пероксидный комплекс Kt – кислород. В последующей стадии актив-ой адс NH3 обр-я новый Kt-кислород- NH3.Далее происх перерасп-е элект-ых связей, и атом азота и водорода соед-я с кисл-ом: 4NH3+5O2=4N2+O2+6H2O.Адсорбированный кисл-д не входит в каталит-ю решетку Pt, незнач-ое его количество нах-ся в растворенном сост-ии,часть адсорбированного кисл-да образует с Pt-ой непр-е связи. В рез-те возн-ет комплекс Kt-кисл-д. Молекулы NH3 также подверг-ся актив-й адс, причем выс-ое химическое сродство водорода к кисл-у ориентирует NH3 к пов-ти Kt-а атомами водорода.Проис-т перераспр-е элек-ых связей, причем с кисл-ом комплекса реаг-ет как водород с обр-еv воды,так и азот NH3-а с образ-ем оксида азота.Поск-у эти соед-я обладают меньшей адс-ой способ-ю, чем исх-е ингрид-ы, то они уносятся к пов-и Kt потоком воздуха. Для р-ии катал-ого окисл-я NH3 хар-ы зависимость скор-и от линейной скорости газа, незнач-я продолж-ть процесса (10-4 – 10-5) и неб-ая энергия активации(до 2,5 кДж/моль),что свойственно дифф-ым процессам. Время окисл-я τ и степень конверсии аммиака до NO α связаны след ур-м: lgτ = -0,107α+7,02*10-6 *α3. Наиболее важным условием ст-и контактир-я NH3 в NO явл актив-ть Kt-а ( Pt – Rh – J), завис от его состава, от характ-ки сеток и от условий их экспл-ции.
Задача1: Время окисл-я аммиака на платиноидном катал-ре при 900 гр сост-ло 8,34*10-5 с. lgτ = -0,107α+7,02*10-6 *α3. Рас-те вел-ну α. Реш-е: Величину α рассч-и методом подбора. lgτ = -4,08α -4,08= -0,107α+7,02*10-6 τ3. После подбора пол-м α = 96%, т.е. -4,08= -4,08. Задача 2: В контак апп-те прот-т р-ция: 2NH3+2,5 O2= 2NО +3Н2О, ΔН= -453,5 кДж при эт прореаг-о 40 кг аммиака. Какой V воз-ха пост-л при эт в конт апп-т, если его избыток сос-л 30%, ск-ко тепла выд-ось. Реш-е: 1) Объем прореаг-го аммиака: 40*22,08/17 = 51,95 м3.2) Объем О2, подан. в конт. ап-т: 51,95*2,5*1,3/2 = 84,42 м3. 3) Объем воз-ха сост-т: 84,42*100/21 = 401,9 м3. 4) Кол-во выдел-гося тепла: на 2*0,02208 м3 NH3 ------ 453,5 кДж, а на 51,95м3 NH3 ---- х кДж→ х = 533499,2 кДж.
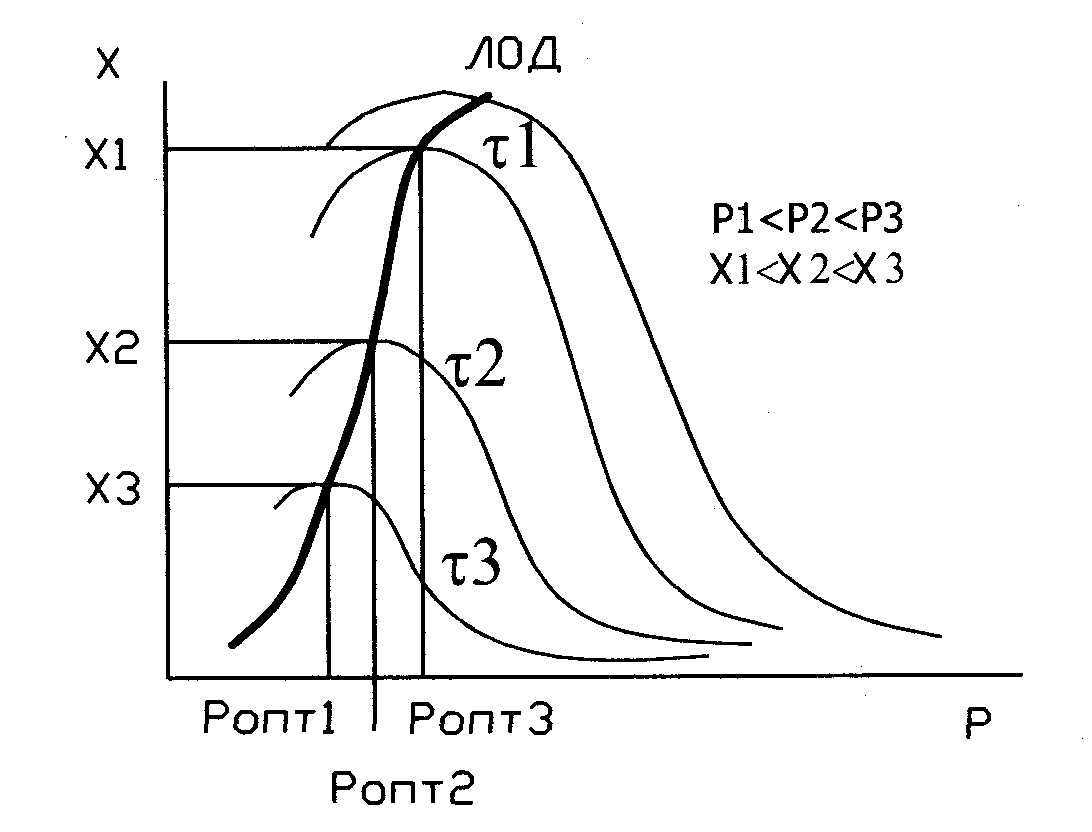
10. Зависимость х = f(P) и х = f(T) для реакции окисления монооксида азота.
 Р-ия окис-я NO в NO2:
Р-ия окис-я NO в NO2:
2 NO+О2 «2 NO2, Н= -114.
Согл. Пр-пу Ле-Шателье
равнов-е обр. экзот-ой
р-ии смещ-ся в стор.
образ-я NO2 при Р (р-ия
идет с ¯ V) и ¯ Т. Пусть про-
исх-т изм. Т и при каждом ее
 изм-и мен-я степ. превр.
изм-и мен-я степ. превр.
Хар-р влия-я Р на изм. Х для
р-ии, идущей с ум.. объема
выглядит след образом:
Задача: Расчет степени окисл-я NO в NO2. Объемн. расход нитрозного газа через полый аппарат-окислитель (V=30 м3) сост-ет 55000 нм3/ч. Объемная доля NO в газе на входе в аппарат равна 2,6 %, а О – 4,0 %. Абс-е давл-е сост-ет 7 атм, а t=80 С. Рас-ть степ. окис. NO в рез-те прох-я НГ через окисл-ль и объем образов-гося NO2.
Расчет:
1) 2 NO+О2 « 2 NO2, Н= -114; Уравн-е для расчета степени окисл-я NO:
t* k* а2*Р2 = 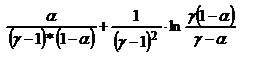 (1). Вычисляем время пребывания газа в окисл-ом объеме, t (с). Для этого необх-мо рассчитать расход газа с учетом реал-го давл-я и темп-ры.
(1). Вычисляем время пребывания газа в окисл-ом объеме, t (с). Для этого необх-мо рассчитать расход газа с учетом реал-го давл-я и темп-ры.
Испол-м ур-е Клапейрона: 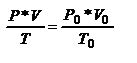 Þ
Þ
V = 1*55000*(273+80)/(273*7)= 10159,6 (м3/ч) = 10159,6/ 3600=2,822 (м3/с);
t=30 /2,822 =10,68 (с).
2)Конст-ту ск-ти при 80 С опред-ем из справ данных: k = (0,00292 + 0,00195)/2 = 0,002435 (1/%об2*с);
3) а=2,6/2=1,3 % об;
4) g=4/1,3=3,07.
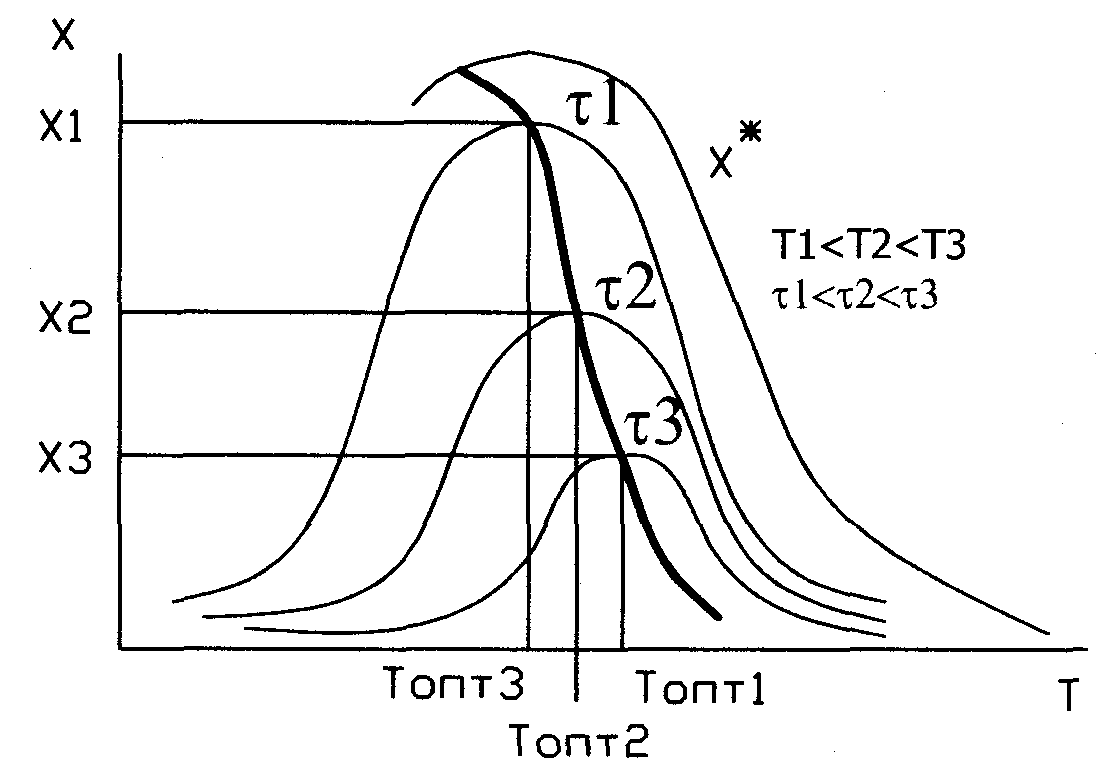
11. Интерпретация зависимости превращения реагента от Т при протекании эндотермической и экзотермической обратимой каталитической реакции.
В соот-и с принц Ле-Шат-е, если на систему, наход-ся в равнов-ии воздейств-ть извне путем измения какого-либо условия определяющего полож-е равновесия, то в этой системе усилится такой процесс, течение которого ослабляет влияние произведенного воздействия. При этом полож-е равнов-я сместится в соотв-м направл-и. Если протек-т обрат экзотер-я реакц-я, то за счет выделяющегося тепла повышается температура реакционной смеси, равновесие сдвиг-ся влево и равнов-я конц-я целевого прод-та уменьшается. Для того, чтобы этого не произошло, необход-о отводить тепло. Для обратим эндотерм-й реакц-, протек-й с поглащ-м тепла необходимо наоборот подводить тепло.
Для обрат экзот-й реакции завис-ть Х=f(T) при некот времени t вначале возрастает, достиг-т макс-го значения, а затем снижается, поскольку процесс ограничен равнов-й степ превр-я. Кривая, соедин-я макс-мы, отражает зав-ть Х=f(T) и является ЛОТ. Она показ-т, что сущ-т температур-я послед-ть, обеспеч-щая макс-ю ск-ть процесса.
Для оратим-й эндотермич реакц-и вопрос о влиянии температуры решается однозначно. Отсутствие экстремум-в говорит об отсутствии оптимал тем-р, а за критерий оптимизации приним-т экономические факторы.
Дата добавления: 2015-04-18; просмотров: 341; Мы поможем в написании вашей работы!; Нарушение авторских прав |