
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Спектральный анализ
Шкала ЭМИ. Источники ЭМИ.
Екванта→
n →
← λ
| 105 | 3∙10-4 | 8∙10-7 | 4∙10-7 | 10-8 | 10-12 | l, м | |||||||||||||
| Радиочастотная область | Микроволновая область | Инфракрасная область | Видимое излучение | Ультрафиолетовая область | Рентгеновское излучение | g - излучение космические лучи | |||||||||||||
| Вращательный спектр | Кол-вращ | Электронный спектр | Изменения | Изменения | |||||||||||||||
| Изменение энергетического состояния спинов электронов. ЭПР - спектроскопия. Изменение энергетического состояния спинов ядер. ЯМР – спектроскопия. | Колебательно - вращательный спектр (колебания атомов в молекуле). ИК - спектроскопия | Изменения в энергетическом состоянии внешних (валентных) электронов. Спектроскопия в УФ и видимой области, КР – спектроскопия. | в энергетическом состоянии внутренних электронов электронной оболочки атомов. | в энергетическом состоянии ядер. Ядерно- физические методы анализа. | |||||||||||||||
Величины, используемые в спектральном анализе: Е, λ, ν, 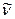 (в некоторых книгах используется символ u вместо
(в некоторых книгах используется символ u вместо 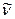 ), связи между ними. Размерности. Физический смысл. [1], с.40. E = h∙ν, λ = c/ ν,
), связи между ними. Размерности. Физический смысл. [1], с.40. E = h∙ν, λ = c/ ν, 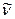 =1/ λ.
=1/ λ.
Спектральный анализ. Физические методы качественного и количественного изучения вещества, основанные на получении и исследовании его спектров. Спектральный анализ классифицируют по целям анализа и типам спектров. Атомный спектральный анализ определяет элементный состав образца по атомным спектрам испускания и поглощения; молекулярный спектральный анализ определяет молекулярный состав вещества по молекулярным спектрам поглощения, люминесценции и комбинационного рассеяния света. Эмиссионный спектральный анализ производят по спектрам испускания атомов, молекул и ионов, возбужденных различными источниками электромагнитного излучения в диапазоне от γ - излучения до микроволнового (радиочастотного). Абсорбционный спектральный анализ осуществляют по спектрам поглощения анализируемых объектов (атомов, молекул, ионов вещества). [3], С.708.
Приведите схемы процессов, лежащих в основе методов спектрального анализа (исключая рентгеновскую спектроскопию).

Рис. Схемы процессов, лежащих в основе методов спектроскопии: а – атомно-эмиссион-ный; б – атомно-абсорбционный; в – атомно-флуоресцентный (резонансный). Горизонтальными линиями изображены основной (внизу) и возбужденный (вверху) уровни энергии валентных электронов.
Непрерывные и линейчатые спектры излучения и поглощения. Ширина линии. Спектральная линия не является строго монохроматичной, а занимает некоторый интервал частот (длин волн). Причины уширения спектральной линии: 1) естественное небольшое уширение (10-5 нм) спектральной линии покоящейся частицы (свободного атома или молекулы) объясняется с помощью соотношения неопределенностей Гейзенберга (∆px ∙∆x < h/4π), 2) наибольший вклад в уширение (10-2 нм) вносят тепловое движение частиц (доплеровское уширение) и столкновение частиц между собой и с другими посторонними частицами (ударное уширение). [6], с.205.
Спектральные линии. Линии в спектрах испускания или поглощения атома, отвечающие определенным электронным квантовым переходам. Спектральные линии уширяются вследствие хаотического теплового движения атомов и молекул (доплеровское уширение). Между тем это уширение невелико, и спектральную линию приближенно считают монохроматической с длиной волны, отвечающей максимуму интенсивности. Спектральная ли-ния характеризуется длиной волны λ частотой ν, волновым числом 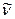 , интенсивностью I.
, интенсивностью I.
Спектр - совокупность спектральных линий испускания или поглощения на спектрограмме.
Классификация спектров. 1) Спектры испускания (эмиссионные), спектры поглощения (абсорбционные), спектры комбинационного рассеяния (СКР). 2) Спектры: атомные, молекулярные. 3) Спектры: рентгеновский, ультрафиолетовый, видимый, инфракрасный. 4) Спектры: электронный, колебательный, вращательный. 5) Спектры непрерывные, полосатые, линейчатые.
Представление состояния электрона в свободном атоме с помощью квантовых чисел: главное квантовое число n = 1 (K), 2 (L), 3 (M), 4 (N), … ;орбитальное квантовое число l = 0 (s), 1 (p), 2 (d), 3 (f), … , n -1;магнитное квантовое число m = 0, ±1, ±2, ± 3, … , ± l ; спин электрона s = ±  . Физический смысл квантовых чисел: энергетический уровень (оболочка) n, энергетический подуровень (подоболочка) l, орбиталь (форма электронного облака) m, спин s заселяющего орбиталь электрона. Состояние электрона в атоме описывается с помощью набора четырех квантовых чисел n, l, m, s (электрон расположен на n –м энергетическом уровне, его l –м подуровне, заселяет орбиталь m этого подуровня, имеет спин s). К - электрон – это электрон, находящийся на К - оболочке атома (n = 1).
. Физический смысл квантовых чисел: энергетический уровень (оболочка) n, энергетический подуровень (подоболочка) l, орбиталь (форма электронного облака) m, спин s заселяющего орбиталь электрона. Состояние электрона в атоме описывается с помощью набора четырех квантовых чисел n, l, m, s (электрон расположен на n –м энергетическом уровне, его l –м подуровне, заселяет орбиталь m этого подуровня, имеет спин s). К - электрон – это электрон, находящийся на К - оболочке атома (n = 1).
Атом в основном состоянии характеризуется минимумом энергии. Принцип Паули: В атоме не может быть двух электронов с одинаковым набором четырех квантовых чисел. Порядок заполнения уровней, подуровней, орбиталей в свободном атоме, находящемся в основном состоянии, регулируется правилом Клечковского: энергия электрона Еn, 1 пропорциональна сумме n + l. Точнее:
 , если n1 + l1 < n2 + l2 или n1 < n2 при n1 + l1 = n2 + l2
, если n1 + l1 < n2 + l2 или n1 < n2 при n1 + l1 = n2 + l2
Орбиталь заселяется не более чем 2-мя электронами с противоположными спинами. Порядок заполнения орбиталей данного подуровня подчиняется правилу Хунда: сумма спинов электронов данного подуровня должна быть максимальной.

Атомные спектры. Атомные спектры возникают при испускании или поглощении электромагнитного излучения свободными или слабо связанными атомами (например, в газах или парах). Атомные спектры линейчатые. Спектральные линии характеризуются частотой ν излучения, которая соответствует определенному квантовому переходу электронов между уровнями энергии En и Emатома согласно соотношению (здесь n и m - не квантовые числа)

Спектральные линии характеризуют частотой ν, длиной волны λ, волновым числом 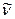 , энергией фотона
, энергией фотона  , интенсивностью I. Атомные спектры обладают ярко выраженной индивидуальностью (они разные для атомов разных элементов). При изучении атомных спектров принимается во внимание, что их вид определяется не только электронным строением атома данного элемента, но и внешними факторами: температурой, давлением, электрическими и магнитными полями. Атомные спектры наблюдаются в УФ, видимой и ИК - областях спектра ЭМИ. Атомные спектры испускания (эмиссионные атомные спектры) возникают при возбуждении атома различными способами: при облучении его светом, пучком электронов и т.п. Атомные спектры поглощения (абсорбционные атомные спектры) возникают при прохождении излучения непрерывного спектра через атомные газы или пары. Атомные спектры получают и наблюдают с помощью спектральных приборов. [1], с.40.
, интенсивностью I. Атомные спектры обладают ярко выраженной индивидуальностью (они разные для атомов разных элементов). При изучении атомных спектров принимается во внимание, что их вид определяется не только электронным строением атома данного элемента, но и внешними факторами: температурой, давлением, электрическими и магнитными полями. Атомные спектры наблюдаются в УФ, видимой и ИК - областях спектра ЭМИ. Атомные спектры испускания (эмиссионные атомные спектры) возникают при возбуждении атома различными способами: при облучении его светом, пучком электронов и т.п. Атомные спектры поглощения (абсорбционные атомные спектры) возникают при прохождении излучения непрерывного спектра через атомные газы или пары. Атомные спектры получают и наблюдают с помощью спектральных приборов. [1], с.40.
Линейчатый спектр водородоподобных атомов (атомов и ионов с одним электроном в электронной оболочке: 1H, 2He+, 3Li2+, 4Be3+, . . .) описывается формулой

где 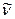 – волновое число линии; R – постоянная Ридберга (R = 10973731.77 ± 0.83 м-1); Z – атомный номер водородоподобного атома; nl и nk – целые числа (главные квантовые числа), определяющие начальный и конечный уровни энергии электрона в атоме (nl < nk). См. рис.1 и 2.
– волновое число линии; R – постоянная Ридберга (R = 10973731.77 ± 0.83 м-1); Z – атомный номер водородоподобного атома; nl и nk – целые числа (главные квантовые числа), определяющие начальный и конечный уровни энергии электрона в атоме (nl < nk). См. рис.1 и 2.

Рис.1.Схема электронных уровней атомарного водорода  , (Z =1). n - главное квантовое число (номер энергетического уровня (электронной оболочки)).
, (Z =1). n - главное квантовое число (номер энергетического уровня (электронной оболочки)).

Рис.2. Спектр атомарного водорода.
Атомно-абсорбционная спектроскопия. Метод элементного анализа и исследования вещества по атомным спектрам поглощения. Длянаблюдения этих спектров через атомный пар пробы пропускают видимое или УФ излучение с непрерывным спектром. В результате поглощения квантов излучения электроны содержащихся в паре атомов переходят с нижних энергетических уровней на возбужденные. Этим переходам в атомном спектре соответствуют так называемые резонансные линии, характерные для данного элемента. Исследуемое вещество атомизируют, распыляя его раствор в пламя газовой горелки. Световой поток после прохождения через поглощающий слой атомного пара и монохроматор, выделяющий резонансную линию, регистрируют фотоэлектрически. В соответствии с законом Бугера-Ламберта-Бэра мерой концентрации элемента в пробе служит доля поглощенной энергии квантов с резонансной частотой. Атомный абсорбционный анализ применяется для определения как следов вещества (до 10-6 %) так и макроколичеств приблизительно 70 элементов в различных объектах - воде, почве, продуктах питания, нефтях, минералах, сплавах. [8], с.59.
Молекулярные спектры. Спектры испускания, поглощения и комбинационного рассеяния света (КРС), принадлежащие свободным или слабо связанным между собой молекулам. Молекулярные спектры – полосатые. Они наблюдаются в виде тесной совокупности более или менее узких полос в УФ, видимой и ИК-областях спектра. При достаточной разрешающей способности спектральных приборов полосы в молекулярных спектрах распадаются на совокупность тесно расположенных линий (полосы состоят из большого числа тесно расположенных спектральных линий). Линии в полосах молекулярных спектров возникают при квантовых переходах между уровнями энергии согласно соотношению

где hν - энергия испускаемого или поглощаемого фотона частоты ν. При КРС hν равна разности энергий падающего и рассеянного фотонов. Молекулярные спектры гораздо сложнее атомных спектров, что определяется большей сложностью внутренних движений в молекуле: кроме движения электронов относительно двух и более ядер в молекуле происходит также колебательное движение ядер (вместе с окружающими их внутренними электронами) около положения равновесия и вращательного движения молекулы как целого. Электронному, колебательному и вращательному движениям молекулы соответствуют три типа уровней энергии: εэл, εкол и εвр и три типа молекулярных спектров. Согласно квантовой механике энергия всех видов движения в молекуле может принимать только определенные значения (квантуется). См. рис. на стр.6, а также [1], с.40.
Молекулы имеют квантованные энергетические уровни электронные, колебательные и вращательные. Переходы между электронными уровнями соответствуют испусканию или поглощению квантов в ультрафиолетовой и видимой областях спектра; переходы между колебательными уровнями – в инфракрасной области; переходы между вращательными уровнями - в микроволновой области спектра. Инфракрасная спектроскопия и спектроскопия комбинационного рассеяния используется для наблюдения внутримолекулярных колебательных переходов. Поглощение света молекулами в ультрафиолетовой и видимой частях спектра обусловлено электронными переходами. График зависимости интенсивности этого поглощения от длины волны света называется спектром поглощения. [4], т.1, с.506.
Электронным, колебательным и вращательным переходам в молекулах соответствуют энергии соответственно 40 - 400; 0.5 - 40; ≤ 0.5 кДж/моль. [1], с.41.
| Энергетические уровни перехода | Энергия квантов, кДж/моль |
| Электронные | 40 - 400 |
| Колебательные | 0.5 - 40 |
| Вращательные | < 0.5 |
Приведите схему энергетических уровней двухатомной молекулы, включающих уровни электронной энергии Ее; уровни колебательной энергии Еv; уровни вращательной энергии Еr. Покажите на этой схеме примеры переходов (vr – переходы, соответствующие вращательному спектру;
vv r - переходы, соответствующие колебательно-вращательному спектру; vevr – переходы, соответствующие электронно – колебательно - вращательному спектру). Совокупность всех этих переходов образует полосатый молекулярный спектр. Близко расположенные линии электронно – колебательно – вращательного спектра при недостаточном разрешении спектрального прибора сливаются в полосы.

Рис. Схема энергетических уровней двухатомной молекулы: Ее - уровни электронной энергии (на рисунке Е0 и Е1 ); Еv – уровни колебательной энергии (vibration – вибрация, колебание) (на рисунке Еv0, Еv1, Еv2 и Еv3); Еr – уровни вращательной энергии (rotation – вращение) (на рисунке Еr0, Еr1, … , Еr6); vr – переходы, соответствующие вращательному спектру; vv r- переходы, соответствующие колебательно-вращательному спектру; vevr – переходы, соответствующие электронно – колебательно - вращательному спектру. Совокупность всех этих переходов образует полосатый молекулярный спектр. Близко расположенные линии электронно – колебательно – вращательного спектра при недостаточном разрешении прибора сливаются в полосы. [6], с.207.
Три параметра, которыми характеризуют спектральную полосу в молекулярных спектрах (полосы в спектрах, возникающих при электронно- колебательных- вращательных переходах в молекулах): λmax –длина волны квантов, которым соответствует максимальная интенсивность Imax, Δλ - ширина полосы на половинной высоте пика.

Интенсивность I спектральной линии. Если энергию фотона Е (или λ, или ν, или 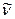 ) определяет положение спектральной линии в спектре, то количество фотонов определяет ее интенсивность. В спектроскопии под интенсивностью линии понимают энергию, испускаемую, поглощаемую или рассеиваемую в единицу времени. [6], с. 203.
) определяет положение спектральной линии в спектре, то количество фотонов определяет ее интенсивность. В спектроскопии под интенсивностью линии понимают энергию, испускаемую, поглощаемую или рассеиваемую в единицу времени. [6], с. 203.
Классификация спектров. Спектры испускания (эмиссионные), спектры поглощения (абсорбционные), спектры комбинационного рассеяния (СКР). Спектры: атомные, молекулярные. Спектры: рентгеновский, ультрафиолетовый, видимый, инфракрасный. Спектры: электронный, колебательный, вращательный. Спектры непрерывные, линейчатые, полосатые.
Схема двухлучевого спектрофотометра (с выходной щелью). Двухлучевая схема спектрофотометра предусматривает два равноценных пути прохождения излучения от одного и того же источника. Один луч проходит через кювету с исследуемой пробой, другой – через такую же кювету с веществом сравнения. Интенсивности потоков измеряют попеременно одним детектором с модулятором, или попеременно с помощью двух детекторов. [Юинг]. С.57.
В спектрофотометре с одним детектором предусмотрено устройство, позволяющее направлять поток излучения поочередно по двум эквивалентным путям (рис.1 и 2). Это устройство имеет вид диска, в котором одна половина имеет зеркальную поверхность, а другая вырезана. Диск вращается электромотором. При повороте диска излучение попеременно отражается от зеркальной поверхности и направляется в кювету сравнения, или проходит через отверстие в диске и кювету с пробой.

Рис.1. Двухлучевая фотометрическая схема с прерывателем. [5], c.59.

Рис.2. Изменение сигнала детектора (рис.1) во времени. Буквами R и S обозначены соответственно потоки от пробы и от раствора сравнения (или чистого растворителя). [5], c.59.
Как обрабатывается сигнал в фотоколориметре или спектрофотометре, когда под один луч попеременно выставляется кювета с пробой (образец исследуемый ОИ) и кювета с растворителем (или образцом сравнения ОС) (см. рис.)? Пусть интенсивность луча перед кюветой с пробой (ОИ) равна I0 , а после – I1. Пусть также интенсивность луча перед кюветой с раствором сравнения равна I0, а после – I2. Соответственно оптические плотности кюветы с пробой и кюветы с раствором сравнения равны D1 и D2.

Рис. Однолучевой абсорбционный спектральный прибор КФК. 1 – источник излучения; 2 - светофильтр; 3 – кюветное отделение; 4 – приемник излучения; 5 - усилитель электрического сигнала; 6 – регистрирующее устройство; ОС – образец сравнения: кювета с чистым растворителем или с раствором исследуемого вещества с точно известной концентрацией; ОИ – кювета с раствором исследуемого вещества.
Луч, проходящий через кювету с раствором изучаемого вещества (ОИ), ослабляется в результате поглощения и рассеяния на 1) частицах растворенного вещества, 2) на молекулах растворителя, 3) на стенках кюветы. Для анализа нужно оставить только полезную первую составляющую потерь излучения. Это достигается в приборах с двумя совершенно одинаковыми кюветами, поочередно выставляемыми на пути луча. В одной кювете содержится исследуемое вещество (ОИ). В другой кювете – только растворитель, или раствор исследуемого вещества с точно известной концентрацией (ОС).
Каким образом при работе с КФК удается избавиться от помех, связанных с поглощением и отражением излучения от растворителя и стенок кюветы?
Запишем выражения для оптической плотности Di следующим образом:
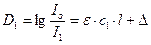

где Δ – поглощение, отражение и рассеивание излучения в растворителе и в кювете,
ε – молярный коэффициент поглощения излучения исследуемым веществом,
с1и с2– молярные концентрации исследуемого вещества в кюветах 1 и 2,
l - длина пути луча в кюветах.
Запишем выражение для разницы между D1 и D2:

Как видно, в полученном выражении нет величины Δ, но осталась только полезная информация. В КФК вычитание  происходит автоматически с помощью мини -ЭВМ.
происходит автоматически с помощью мини -ЭВМ.
При анализе обычно обеспечивают с2 = 0, т.е в кювете сравнения используется чистый растворитель. Тогда
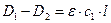 .
.
Т.е., на экран дисплея КФК выводится величина  , пропорциональная искомой концентрации с1. Из полученного выражения следует, что величины
, пропорциональная искомой концентрации с1. Из полученного выражения следует, что величины  и с1 связаны линейно. Следовательно, и калибровочные графики также должны быть линейными.
и с1 связаны линейно. Следовательно, и калибровочные графики также должны быть линейными.
Чем отличаются фотоколориметрический и спектрофотометрический методы? Фотоколориметрический метод основан на измерении поглощения веществом полихроматического света, выделяемого из сплошного спектра излучения внешнего источника с помощью светофильтра (окрашенное стекло). Ширина вырезаемого с помощью светофильтра спектрального диапазона Δλ составляет 20 -100 нм. Спектрофотометрический анализ основан на регистрации и измерении поглощения монохроматического излучения, выделяемого из сплошного спектра излучения с помощью призмы или дифракционной решетки и щели. С помощью щели интервал Δλ обеспечивают значительно более узким: 1 - 2 нм). [1], с.44.
В аналитических химических лабораториях наиболее распространенным и дешевым прибором является фотоколориметр КФК. Фотоколори́метр — оптический прибор для измерения концентрации веществ в растворах. Действие колориметра основано на свойстве окрашенных растворов поглощать проходящий через них свет тем сильнее, чем выше в них концентрация окрашивающего вещества. В отличие от спектрофотометра, измерения в фотоколориметре ведутся в луче не монохроматического, а полихроматического (но с узким спектральным диапазоном) света, формируемого светофильтром (окрашенным стеклом). Применение различных светофильтров (цветных стекол) с узкими спектральными диапазонами пропускаемого света позволяет определять по отдельности концентрации разных компонентов одного и того же раствора. В отличие от спектрофотометров, фотоколориметры просты, недороги и при этом обеспечивают точность, достаточную для многих применений. В качестве приёмников излучения в фотоколориметрах используются фотоэлементы (селеновые и вакуумные), фотоэлектронные умножители (ФЭУ), фоторезисторы (фотосопротивления) и фотодиоды. Сила фототока приемников определяется интенсивностью падающего на них света и, следовательно, степенью его поглощения в растворе (тем большей, чем выше концентрация). Показания фотоколориметра (оптическая плотность) не дают сразу значений концентрации исследуемого вещества в растворе — для перехода от оптической плотности к концентрации используют градуировочные графики, полученные при измерении оптической плотности растворов с известными концентрациями. Градуировочные графики строят в координатах D – c. Измерения с помощью фотоколориметра отличаются простотой и быстротой проведения. Точность их во многих случаях не уступает точности других, более сложных методов химического анализа. Нижние границы определяемых концентраций составляют от 10−3 до 10−8 моль/л.
Приведите выражения для оптической плотности D и оптического пропускания T.
 (*)
(*)
где Iλ0 – интенсивность луча с длиной волны λ, прошедшего через кювету с растворителем; Iλ – интенсивность луча, прошедшего через кювету с растворителем и растворенным в нем исследуемым веществом. Обратите внимание - в формуле (*) логарифм десятичный! Если в (*) концентрация с исследуемого вещества выражена в моль/л, а длина пути l луча в поглощающей среде – в см, то коэффициент поглощения kλ обозначают символом ελ и называют молярным коэффициентом поглощения (или коэффициентом экстинкции). Молярный коэффициент поглощения ελ зависит от λ (от ν) и от химической природы и состояния вещества.
[ελ] = л/(моль∙см). [1], с. 44, 49.
Спектрофотометрический анализ. Изобразите правдоподобный вид спектра поглощения (зависимость молярного коэффициента поглощения ελ электромагнитной энергии чистым органическим веществом) в УФ - области от длины волны излучения. Можно ли по виду такой зависимости идентифицировать поглощающее вещество, если оно единственное в пробе? А если в пробе присутствует смесь веществ?
Молярный коэффициент ελ поглощения вещества. Смотри рис. 1 и 2 зависимостей ελ от λ для разных веществ.

Рис.1. Спектрофотометрмческий анализ. Ультрафиолетовый спектр поглощения (зависимость молярного коэффициента поглощения ελ электромагнитной энергии бутеном-1 (1) и бутаноном (2) от длины волны излучения в УФ-области электромагнитного спектра.) По оси ординат отложен молярный коэффициент поглощения ελ (в лагарифмической шкале). По виду такой зависимости с помощью атласа спектров можно идентифицировать чистое поглощающее вещество, если оно единственное в анализируемой пробе. А если в пробе два известных вещества, то их концентрации можно найти, используя закон аддитивности оптических плотностей. [9], том 2, с.333. См. также рис. на стр. 16 данного пособия.

8.3 12.5 → l , мкм
Рис.2. Зависимость молярного коэффициента поглощения ελ электромагнитной энергии n-гексаном (а) и 2-метилпентаном (б) от длины волны излучения в ИК - области электромагнитного спектра. По оси ординат отложен молярный коэффициент поглощения ελ (в линейной шкале). По виду такой зависимости с помощью атласа спектров можно идентифицировать чистое поглощающее вещество, если оно единственное в анализируемом растворе.
Люминесценция.[8], с.306. Свечение вещества, возникающее после поглощения им энергии возбуждения. Люминесценция представляет собой избыточное излучение по сравнению с тепловым излучением тела при данной температуре. Длительность люминесценции от 10-10 с. до нескольких часов. Люминесценция наблюдается в УФ, видимой и ИК областях спектра ЭМИ. Кратковременную люминесценцию, затухающую сразу после прекращения ее возбуждения, называют флуоресценцией; длительную люминесценцию, продолжающуюся некоторое время после ее возбуждения – фосфоресценцией. Источником возбуждения люминесценциии может быть свет (фотолюминесценция), электрическое поле (электролюминесценция), механическая деформация (триболюминесценция), химические реакции (хемолюминесценция, например, свечение жучков-светлячков), рентгеновские лучи (рентгенолюминесценция), пучок быстрых электронов (катодолюминесценция) и т.п.
Люминесценция подразделяется на флуоресценцию (переизлучение атомов и молекул сразу после возбуждения) и фосфоресценцию (переизлучение молекул (только молекул, но не атомов) спустя заметное время после возбуждения). [1],с. 39.
Резонансная флуоресценция – энергия испускаемого (переизлученного) кванта равна энергии поглощенного. Нерезонансная флуоресценция - энергия испускаемого кванта не равна энергии поглощенного. При этом помним, что Е = hν.
Люминесцентный анализ. [8], с.306. Совокупность методов анализа, основанных на явлении люминесценции. Широко применяется анализ, основанный на фотолюминесценции исследуемого вещества, возбуждаемой УФ излучением, источником которого служат, например, ртутно - кварцевые или ксеноновые лампы и лазеры. Регистрируют люминесценцию визуально или фотоэлектрически (с помощью спектрофотометра). Качественный анализ (по спектру люминесценции) используется для обнаружения следов токсичных и канцерогенных веществ. Количественный анализ основан на зависимости интенсивности люминесценции от количества люминесцирующего вещества.
С помощью добавки соли флуоресцеина исследуются подземные потоки воды. Флуоресцеин даже при очень малых концентрациях ярко светится зеленым цветом при облучении ультрафиолетовыми лучами (от Солнца или от бактерицидной лампы). Очевидно, что это не резонансная флуоресценция (поглощается невидимое УФ - излучение, а испускается видимый свет).


Рис. Слева. В Чикаго на местном празднике ежегодно в декоративных целях окрашивают реку флуоресцеином, растворяя в воде всего несколько килограммов вещества. В реке флуоресцеин ярко светится зеленым цветом под действием УФ-излучения Солнца. Флуоресцеин не вреден для биоты. Фотография справа. В колбе растворенный в воде флуоресцеин светится под действием УФ-излучения бактерицидной лампы в темной комнате.
Фотометрия пламени. Область применения. [3], с.826. Один из видов эмиссионного спектрального анализа. Применяется для количественного определения в растворах щелочных, щелочноземельных и редкоземельных элементов по их спектральным линиям или полосам. Источником возбуждения спектров является высокая температура пламени водорода или ацетилена. Анализируемый раствор распыляется в пламя в виде аэрозоля в токе кислорода или воздуха. Наиболее удобно для возбуждения спектра водород-кислородное пламя, имеющее высокую температуру 2900 К и малую интенсивность (в видимой области) собственного излучения. Измерение интенсивностей спектральных линий производится фотоэлектрическим способом. Фотометрию пламени отличают точность и быстрота анализа, малый предел обнаружения компонентов смеси (для щелочных элементов 0.01 мкг/мл, для щелочноземельных – 0.1 мкг/мл). Сравни с атомным адсорбционным анализом.
Простейший опыт, иллюстрирующий метод фотометрии пламени. Надо растворить в воде немного поваренной соли NaCI, обмакнуть в полученный раствор платиновую проволочку и внести ее в бесцветное пламя газовой горелки. Атомы натрия окрашивают бесцветное пламя (рис. 1) в оранжевый цвет. При разложении излучения в спектр с помощью призмы обнаруживается несколько линий натрия, в том числе очень яркая линия 589 нм и три линии в районе 650 нм (рис.2).

Рис.1. Окрашивание бесцветного пламени газовой горелки (часть пламени ниже проволочки) в оранжевый цвет атомами натрия (часть пламени выше проволочки).

Рис.2. Линейчатый спектр паров натрия в видимом диапазоне частот (верхняя часть фотографии). В нижней части фотографии для сравнения приведен сплошной спектр.
Роберт Вуд – история с анализом котлеты на содержание в ней соли лития (яркая красная линия) с использованием метода фотометрии пламени. [В. Сибрук. Роберт Вуд], с.44.
Как выглядит линейчатый спектр излучения и спектр поглощения лития в видимом диапазоне ЭМИ?

|
Рис. 1. Линейчатый спектр излучения лития в видимом диапазоне.

|
Рис. 2. Линейчатый спектр поглощения лития в видимом диапазоне.
Характеристические линии и линии отпечатков пальцев. Поясните. В какой области спектра? Атомный или молекулярный спектр?
ИК - спектроскопия. Область характеристических полос и область «отпечатков пальцев».

3000 1200 800 ← u , см-1
9 ∙1013 3.6∙1013 2.4∙1013 ← n , Гц
3.3 8.3 12.5 → l , мкм
Рис.1. Инфракрасный (ИК) спектр поглощения пропанона СН3 – СО - СН3 и бутанона
СН3 – СО - СН2 - СН3. Слева расположен участок спектра, называемый характеристическим. По характеристическому спектру можно определить наличие в молекулах пропанона и бутанона определенных функциональных групп: ≡ СН, = С = О, ≡ С - С≡ . Этот участок спектра одинаков и для пропанона и для бутанона. Справа расположен участок спектра, называемый областью отпечатков пальцев. Спектры поглощения пропанона и бутанона здесь различны. По спектрам в области отпечатков пальцев можно точно идентифицировать анализируемое вещество. По оси абсцисс отложены волновые числа u. Для удобства ниже шкалы волновых чисел u расположены шкалы частотn и длин волн l. [9], с.333. Внимание: на рисунке изображены спектры чистых веществ (не смеси): пропанона и бутанона. Смотри также спектры бутена-1 и бутанона в УФ-области на стр.9 данного пособия.
Характеристические частоты (характеризуют что?). Это одинаковые или мало отличающиеся друг от друга частоты колебаний определенных групп атомов в различных молекулах. Эти частоты соответствуют определенным химическим связям, например,
≡ С – Н , ≡ С – С ≡ , = С = С = , ≡ С – Cl , = С = О и др.
Монохроматоры ЭМИ. Монохроматор (призма, дифракционная решетка плюс щель) – прибор, выделяющий узкую полосу длин волн из широкой части спектра. В призмах угол преломления падающего на нее света зависит от длины волны. При выборе материала для призмы учитывается пропускание через нее излучения нужного спектрального диапазона. В дифракционной решетке лучи, отраженные от различных штрихов решетки, интерферируют. В обоих случаях световые лучи с разными длинами волн наблюдаются под разными углами. [6], с.217.
Какие материалы можно использовать для изготовления призм для работы в УФ- и в ИК- областях спектра?


Рис. Прозрачность разных материалов (флюорит CaF2, вода, плавленый кварц SiO2, увиолевое стекло, оконное стекло) в ультрафиолетовой области (слева) и в инфракрасной области (справа). Для справки: 1мкм = 10 000 ангстрем.
Оптическая плотность Dλ = lg(Ioλ/Iλ).
Пропускание Tλ = Iλ/Ioλ.
Закон поглощения электромагнитного излучения (закон Бугера-Ламберта-Бера):
Iλ = Iλo exp(-kλ*∙ l) = Iλo ∙ 10- k ∙ l = Iλo ∙ 10-ε∙c∙l
где k*λ=2.3 kλ, In10 = 2.3.InIλ = InIλo - kλ∙l∙In10
где ελ – молярный коэффициент поглощения излучения с длиной волны λ, c – молярная концентрация исследуемого вещества в растворе, l - длина пути луча в поглощающей среде.
Закон поглощения электромагнитного излучения (Закон Бугера-Ламберта-Бэра). [1], с.43.

Зависимости оптической плотности D от концентрации c поглощающих частиц 1) при подчинении закону Бера, 2) при положительном отклонении от закона, 3) при отрицательном отклонении. Причины отклонения разделяют на инструментальные и химические. Немонохроматичность излучения приводит к отрицательным отклонениям от основного закона поглощения света – это инструментальная причина. Химические причины обусловлены изменением числа поглощающих частиц вещества вследствие протекающих в растворе реакций протонирования, окисления - восстановления, комплексо - и осадкообразования. Вызванные химическими причинами отклонения могут быть положительными и отрицательными.

Рис. Кривые зависимости оптической плотности от концентрации при подчинении закону Бэра (1), при положительном отклонении (2), при отрицательном отклонении (3). [5], с.50
Закон аддитивности оптических плотностей. Оптическая плотность смеси веществ, подчиняющихся основному закону поглощения света и не вступающих в химические реакции друг с другом, равна сумме парциальных оптических плотностей, характеризующих поглощение каждого вещества в отдельности:
Dλ∑= ΣDλi = l∙ Σ kλi ∙ ci,
где Dλ∑– оптическая плотность смеси веществ; Dλi= kλi∙ l∙ ci – парциальная оптическая плотность i-го вещества; kλiи сi – коэффициент поглощения и концентрация i-гo вещества. Закон аддитивности оптических плотностей позволяет определять концентрации компонентов в их смесях, используя знание оптической плотности смеси веществ Dλ∑ и знание парциальных оптических плотностей Dλi чистых веществ, содержащихся в смеси.Поясните использование этого закона на примере анализа спектра смеси двух веществ с целью нахождения концентраций каждого компонента. [5], с.86 и [2].

Рис. Гипотетический пример анализа двухкомпонентной смеси на спектрофотометре. Здесь буквой А обозначены оптические плотности компонентов 1 и 2 и смеси компонентов 1 и 2, обозначенной цифрой 3. [5], с.88.
Спектры ИК. Колебательные спектры регистрируют в форме инфракрасного спектра поглощения (ИК-спектров) или эмиссионных спектров комбинационного рассеяния (спектров КР или, то же самое, рамановских спектров). ИК-спектр представляет собой спектр поглощения в инфракрасной области.
Спектры комбинационного рассеяния (КР). [6], с.295. Спектр КР возникает при облучении вещества монохроматическим светом УФ или видимого диапазона. Под воздействием монохроматического светового потока с частотой v на молекулы вещества, они поляризуются и рассеивают падающий на них свет. Рассеянный свет с неизмененной частотой v называют релеевским рассеянием. Одновременно в рассеянном свете присутствуют и кванты с измененными частотами v ± voi (комбинационное рассеяние), где voi – частота нормальных колебаний атомов в молекуле. Т.о. колебательные частоты наблюдаются в виде комбинационных смещений частоты возбуждающего света v в УФ или видимой области спектра. Частоты v - voi называют стоксовыми, а частоты v + voi - антистоксовыми.

Рис. Спектр комбинационного рассеяния жидкого СCI4, полученный при возбуждении СCI4 Не-Nе лазером при 632.8 нм. (0.6328 мкм). Большой пик ∆  = 0 связан с релеевским рассеянием. Как видно из рисунка, частоты ≈ 200, ≈ 300 и ≈ 450 см-1 соответствуют частотам взаимных колебаний атомов С и СI в молекуле СCI4. [5], с.168. [6], с.297.
= 0 связан с релеевским рассеянием. Как видно из рисунка, частоты ≈ 200, ≈ 300 и ≈ 450 см-1 соответствуют частотам взаимных колебаний атомов С и СI в молекуле СCI4. [5], с.168. [6], с.297.

Рис. Спектрограф (справа) - прибор, сходный со спектрофотометром, но без выходной щели. На ее месте ставят фотопластинку или диодную матрицу (такие же матрицы дают изображение в цифровых фотоаппаратах). В спектрофотометре (слева) вместо фотографической пластинки или матрицы располагают фотоэлектрический детектор. На рис. после призмы изображен пучок лучей с разной длиной волны. Поворачивая призму, можно направлять в выходную щель лучи с разной длиной волны.

Рис. Схема спектрофотометра для измерения спектра поглощения раствора. Вращая призму, можно последовательно направлять на образец лучи света с различной длиной волны. Регистрирующее устройство измеряет интенсивность света , прошедшего через образец, и эти данные позволяют устанавливать способность исследуемого вещества поглощать свет той или иной длины волны. Зависимость интенсивности поглощения света образцом вещества от длины волны называется спектром поглощения вещества. [Т.Браун, Г.Ю.Лемей]
Спектрофотометр СФ-16. Он стоит в лаборатории кафедры экологии. Используется для измерения коэффициента пропускания жидких и твердых тел в области 180 - 1100 нм (0.18 - 1.1 мкм). Для обеспечения работы спектрофотометра в широком диапазоне длин волн, используются два источника сплошного спектра (дейтериевая лампа для работы в области спектра 180 - 350 нм и лампа накаливания в области спектра 340 - 1100 нм.) и два фотоэлемента: сурьмяно-цезиевый фотоэлемент, применяемый для измерений в области спектра от 186 до 650 нм, и кислородно-цезиевый фотоэлемент (600 - 1100 нм). Ртутно-гелиевый спектр лампы ДРГс-12 используется для градуировки (что это такое?). 4 светофильтра (какие характеристики?). Погрешность 1% абс. Среднее квадратичное отклонение 0.2%.
Спектр линейчатый (спектр независимых атомов), полосатый (спектр независимых молекул), сплошной (спектр нагретых твердых тел, атомы и молекулы которых считать независимыми нельзя).
Источники возбуждения эмиссионных спектров: свет (фото), электрическое поле, механическая деформация, химическая реакция, рентгеновские лучи, поток электронов.
Оптический диапазон включает: УФ, видимую, ИК - области спектра. [1], с. 40.
УФ-область спектра подразделяется на дальнюю (вакуумную) и ближнюю. [1],с. 40. Вакуумная часть УФ - области солнечного света полностью поглощается атмосферой и до Земли не доходит. Ближняя – поглощается частично.
ИК-диапазон спектра подразделяется на ближнюю (к области видимого света), среднюю и дальнюю области. [1], с. 40.
Методы спектрального анализа: рентгеновская спектрометрия, оптическая, радиочастотная (ЭПР, ЯМР). [1], с.38.
Энергетические состояния атома, молекулы: основное с минимальной энергией, возбужденное (с переходом электронов с основных на возбужденные уровни). [1], с.38.
Резонансные спектральные линии. Возникают при переходе атома или молекулы в основное состояние из возбужденного, или из основного состояния в возбужденное. [1], с.38.
Спектры испускания: эмиссионные, люминесцентные. Возбуждение спектров: γ-излучением, рентгеном, видимым светом, потоками заряженных микрочастиц.
Связь частоты и длины волны излучения с энергией перехода:

где h = 6.626 ∙10-34 Дж∙ с (постоянная Планка); ν – частота излучения, 1/с.
Основание для выбора спектра испускания или поглощения. Соотношение интенсивностей линий, отвечающих одному и тому же переходу i ↔ j в спектрах испускания (эмиссии) Iе и поглощения (адсорбции) Iа различно и зависит от частоты кванта, соответствующего этому переходу:
(Iе / Iа) ~ v 3
т.е. с увеличением частоты v интенсивность линии испускания (эмиссии) во много раз превосходят интенсивность линий поглощения. Поэтому спектры испускания исследуют в рентгеновской, УФ и видимой областях (высокие частоты v). А спектры поглощения удобнее исследовать в ИК, микроволновой и радиочастотной областях (низкие частоты v). [5], с.204.
Закон Планка Еν= f(ν, Т) распределения излучаемой черным телом энергии в зависимости от νи Т ). Закон Вина λmax = b/T о длине волны λmax, на которую приходится максимум Еmax лучистой энергии в спектре излучения черного тела.

Рис. Распределение лучистой энергии в спектре абсолютно черного тела (закон Планка). По оси ординат отложена величина Е, Вт/(м2 ∙ nm). ν = с/λ
Устройство источника рентгеновских лучей (рентгеновской трубки)

Рис. Рентгеновская трубка. Ускоренные в электрическом поле электроны попадают на металлический анод (а катод-источник электронов). При столкновении с анодом энергия электронов преобразуется в энергию рентгеновских лучей, выходящих из трубки через бериллиевое окошко (бериллий пропускает рентгеновское излучение). Спектр излучения рентгеновского излучения зависит от металла анода (см. закон Мозли) и от ускоряющего электроны напряжения (ускоряющее напряжение). Питание накала предназначено для нагрева спирали источника электронов. Высоковольтный источник питания (ускоряющее напряжение) предназначен для сообщения пучку электронов заданной энергии.
Рентгеновская спектроскопия. Область применения. [8], с.506
Методы рентгеновской спектроскопии применяются для неразрушающего анализа веществ (рентгеновский спектральный анализ). Используется главным образом эмиссионная рентгеновская спектроскопия. Различают первичное и вторичное рентгеновское излучение. Первичное рентгеновское излучение получают бомбардировкой заряженными частицами (электронами) исследуемого образца (анода), служащего мишенью в рентгеновской трубке. Вторичное (флуоресцентное) рентгеновское излучение получают облучением исследуемого образца электромагнитным излучением. В первичном рентгеновском излучении выделяют тормозное и характеристическое излучения. Тормозное излучение обусловлено рассеянием заряженных частиц на атомах, характеристическое рентгеновское излучение – ионизацией атома с выбрасыванием электрона с одной из внутренних оболочек. Спектр тормозного излучения сплошной, характеристического - линейчатый. Возбуждение первичного характеристического излучения осуществляется пучком электронов с энергией 10 – 100 кэВ или (1.6 – 16) ∙10-15 Дж. Возбуждение вторичного (флуоресцентного) излучения осуществляется рентгеновским (не электронами) и γ - излучением. Соответственно различают рентгеноспектральный анализ и рентгеновский флуоресцентный анализ. Прибор для рентгеновского флуоресцентного анализа состоит из рентгеновской трубки, дифракционной решетки и детектора – счетчика ионизирующего излучения.
Рентгенофлуоресцентный анализ. Основан на сборе и последующем анализе спектра, полученного путем воздействия на исследуемый материал рентгеновским излучением (не электронами). При облучении атомы исследуемого материала переходят в возбужденное состояние в результате ионизации внутреннего, например, К-уровня. В возбужденном состоянии атом пребывает крайне малое время, после чего возвращается в основное состояние: электроны с внешних оболочек либо заполняют образовавшиеся вакантные места на К-уровне, а излишек энергии испускается в виде фотона, либо энергия передается другому электрону из внешних оболочек (испускаются оже-электрон). При этом каждый атом испускает фотоэлектрон (оже-электрон) с энергией строго определенного значения.
Дата добавления: 2015-04-21; просмотров: 1715; Мы поможем в написании вашей работы!; Нарушение авторских прав |