
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Медицинское применение
Разбавленные растворы (около 0,1 %) перманганата калия нашли широчайшее применение в медицине как антисептическое средство, для полоскания горла, промывания ран, обработки ожогов. В качестве рвотного средства для приёма внутрь при некоторых отравлениях используют разбавленный раствор.
34. Общая характеристика триады железа. Роль в живом организме.
| Свойства | 26Fe | 27Co | 28Ni |
| Электронная конфигурация* | 
| 
| 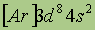
|
| Возможные степени окисления | +2, +3, +6 | +2, +3 | +2, +3, +4 |
| агрегатное состояние (н. у.) | Т В Е Р Д Ы Е В Е Щ Е С Т В А |
Общая характеристика. Элементы железо, кобальт и никель образуют триаду железа, или семейство железо. Атомы элементов триады железа имеют на внешнем энергетическом уровне по 2 электрона, которые они отдают в химических реакциях.
Кобальт и никель менее реакционноспособны, чем железо.
Препараты железа принимают при анемии, малокровии, а так же как кровоостанавливающее средство; в зависимости от концентрации оказывают вяжущее и прижигающее действие
В ветеринарной практике используются металлорганические соединения кобальта , в том числе цианокобаламин и коамид.
Никель – его избыток в почве и растениях может быть причиной заболеваний. (болезни глаз у животных, “боанг” у кокосовых пальм (пустые орехи))
35. Железо, строение атома, степени окисления. Изменение свойств соединений с изменением степени окисления железа. Роль в живом организме. Применение.
26Fe
Степени окисления +2, +3, +6
26 протонов, 26 нейтронов
Соединения железа (II)
Оксид железа(II) FeO обладает основными свойствами, ему отвечает основание Fe(OH)2. При их хранении, особенно во влажном воздухе, они коричневеют за счёт окисления до железа (III). Такой же процесс протекает при хранении водных растворов солей железа(II):
4FeCl2 + O2 + 2H2O → 4Fe(OH)Cl2.
Из солей железа(II) в водных растворах устойчива соль Мора — двойной сульфат аммония и железа(II) (NH4)2Fe(SO4)2·6Н2O.
Реактивом на ионы Fe2+ в растворе может служить гексацианоферрат(III) калия K3[Fe(CN)6] (красная кровяная соль). При взаимодействии ионов Fe2+ и [Fe(CN)6]3− выпадает осадок турнбулевой сини:
3K3[Fe(CN)6] + 3Fe2+ → 3KFeII[FeIII(CN)6]↓ + 6K+.
Для колчиественного определения железа (II) в растворе используют фенантролин Phen, образующий с железом (II) красный комплекс FePhen3 (максимум светопоглощения — 520 нм) в широком диапазоне рН (4-9).
Соединения железа (III)
Оксид железа(III) Fe2O3 слабо амфотерен, ему отвечает ещё более слабое, чем Fe(OH)2, основание Fe(OH)3, которое реагирует с кислотами:
2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 6H2O.
Соли Fe3+ склонны к образованию кристаллогидратов. В них ион Fe3+ как правило, окружен шестью молекулами воды. Такие соли имеют розовый или фиолетовый цвет.
Ион Fe3+ полностью гидролизуется даже в кислой среде. При рН>4 этот ион практчиески полностью осаждается в виде Fe(OH)3:
Fe3+ + 3H2O = Fe(OH)3 + 3H+
При частичном гидролизе иона Fe3+ образуются многоядерные оксо- и гидроксокатионы, из-за чего растворы приобретают коричневый цвет.
Основные свойства гидроксида железа(III) Fe(OH)3 выражены очень слабо. Он способен реагировать только с концентрированными растворами щелочей:
Fe(OH)3 + 3КОН → K3[Fe(OH)6].
Образующиеся при этом гидроксокомплексы железа(III) устойчивы только в сильно щелочных растворах. При разбавлении растворов водой они разрушаются, причём в осадок выпадает Fe(OH)3.
При сплавлении со щелочами и оксидами других металлов Fe2O3 образует разнообразные ферриты:
Соединения железа(III) в растворах восстанавливаются металлическим железом:
Fe + 2FeCl3 → 3FeCl2.
Железо(III) способно образовывать двойные сульфаты с однозарядными катионами типа квасцов, например, KFe(SO4)2 — железокалиевые квасцы, (NH4)Fe(SO4)2 — железоаммонийные квасцы и т. д.
Для качественного обнаружения в растворе соединений железа(III) используют качественную реакцию ионов Fe3+ с тиоцианат-ионами SCN−. При взаимодействии ионов Fe3+ с анионами SCN− образуется смесь ярко-красных роданидных комплексов железа [Fe(SCN)]2+, [Fe(SCN)2]+, Fe(SCN)3, [Fe(SCN)4]- Состав смеси (а значит, и интенсивность её окраски) зависит от различных факторов, поэтому для точного качественного определения железа этот метод неприменим. Другим качественным реактивом на ионы Fe3+ служит гексацианоферрат(II) калия K4[Fe(CN)6] (жёлтая кровяная соль). При взаимодействии ионов Fe3+ и [Fe(CN)6]4− выпадает ярко-синий осадок берлинской лазури:
4K4[Fe(CN)6] + 4Fe3+ → 4KFeIII[FeII(CN)6]↓ + 12K+.
Соединения железа (VI)
Ферраты — соли не существующей в свободном виде железной кислоты H2FeO4. Это соединения фиолетового цвета, по окислительным свойствам напоминающие перманганаты, а по растворимости — сульфаты. Получают ферраты при действии газообразного хлора или озона на взвесь Fe(OH)3 в щелочи, например, феррат(VI) калия K2FeO4. Ферраты окрашены в фиолетовый цвет.
Ферраты также можно получить электролизом 30%-ного раствора щелочи на железном аноде:
Fe + 2KOH + 2H2O = K2FeO4 + 3H2 Ферраты — сильнейшие окислители. В кислой среде разлагаются с выделением кислорода::
4FeO42- + 20H+ = 4Fe3+ + 3O2 + 10H2O
Окислительные свойства ферратов используют для обеззараживания воды.
Дата добавления: 2015-04-21; просмотров: 255; Мы поможем в написании вашей работы!; Нарушение авторских прав |