
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Закон Амага
Этот закон показывает свойство аддитивности парциального объёма.
vсм=Svi
vi/vсм=ni/N=yi
vi=yi×vcм
Используются в расчётах газовых месторождений.
33. Уравнение состояния идеальных газов, коэффициент сверхсжимаемости
См.30
КОЭФФИЦИЕНТ СВЕРХСЖИМАЕМОСТИ ПРИРОДНЫХ ГАЗОВ
Газы - реальные и идеальные.
Идеальные газы – это когда пренебрегают взаимодействием молекул друг с другом.
PV = GRT
 Р – абсолютное давление (Па), V – объем (м3), G – масса вещества (кг), Т – температура (К), R – универсальная газовая постоянная (кДж/К×кг).
Р – абсолютное давление (Па), V – объем (м3), G – масса вещества (кг), Т – температура (К), R – универсальная газовая постоянная (кДж/К×кг).

 (для идеального газа).
(для идеального газа).
z - степень отклонения реального газа от идеального, или коэффициент сжимаемости реального газа.
34. Уравнение Ван-дер-Вальса и его физический смысл
Свойство идеальных газов заключается в том, что: Р×V/(G×R×Т)=1=z.
Новый введённый нами коэффициент z, который для идеальных газов равен 1, а для реальных газов отличен от неё, называется коэффициентом сверхсжимаемости.
z – коэффициент, с помощью которого свойства идеальных газов прилагаются к реальным. Он характеризует степень отклонения идеального газа от реального.
Были проведены различные попытки усовершенствования описания:
1) Уравнение Ван-дер-Ваальса:
(Р+а/v2)(v-в)=R×Т,
где v – удельный объём; в – поправка на объём молекул; а/v2=соnst – константа сцепления молекул.
Величина а/v2 выражает внутреннее давление, которое является как бы равнодействующей силой притяжения всех молекул в объёме v.
При давлениях до 100 МПа, и температурах Т=150°С необходимо определить наиболее точное описание зависимостей. В рассмотрении этого вопроса наука пошла по двум направлениям:
1. введение коэффициента сверхсжимаемости z;
2. добавление в уравнение состояния дополнительных констант.
2) Любую экспериментальную зависимость можно описать с помощью полинома, поэтому был избран путь увеличения количества констант. Наиболее распространёнными оказались уравнения с пятью константами Битти-Бриджмена и восьмью константами Бенедикта-Вебба-Рубина. Все постоянные величины определяются методом наименьших квадратов.
35. Приведенные и критические параметры газов и их смесей
I. Введение z в уравнение состояния. На основе экспериментов выяснилось: если у нас приведённые параметры Рпр, Тпр одинаковы и находятся в соответствующих состояниях, то при этом такие термодинамические свойства, как коэффициент сверхсжимаемости, одинаковы для различных газов. Т.е. z=f(Рпр, Тпр).
Приведённые параметры идеальных компонентов – безразмерные величины, показывающие, во сколько раз действительные параметры состояния газов больше критических. Под параметрами понимаются: Рабс, Т, V и z.
Тпр=Т/Ткр; Рпр=Р/Ркр; zпр=z/zкр.
Приведённые параметры рассчитываются на основании критических параметров, отсюда рассмотрим вопрос определения критических параметров.
 Ркр=Sуi×Ркрi; Ткр=Sуi×Ткрi; zкр=Sуi×zкрi
Ркр=Sуi×Ркрi; Ткр=Sуi×Ткрi; zкр=Sуi×zкрi
Зависимости приведённых параметров выглядят следующим образом: z Тпр
Рпр
36 Зависимость коэффициента сверхсжимаемости природного газа от приведенного давления и температуры
Приведенный параметр – это безразмерная величина, показывающая, во сколько раз параметры P,V,r больше или меньше критических.

 Реальные газы – смесь углеводородных и не углеводородных компонентов. Молекулы аргона, ксенона, криптона и метана имеют сферическую конфигурацию. Молекулы таких газов, как пропан и бутан, - несферическую, поэтому для учёта формы молекул был введён параметр – ацентрический фактор (w). Он показывает, что если молекула сферическая, то силы, которые на неё действуют – сферические, что указывает на симметрию сил. Если же молекулы не сферические, то возникает асимметрия действующих сил.
Реальные газы – смесь углеводородных и не углеводородных компонентов. Молекулы аргона, ксенона, криптона и метана имеют сферическую конфигурацию. Молекулы таких газов, как пропан и бутан, - несферическую, поэтому для учёта формы молекул был введён параметр – ацентрический фактор (w). Он показывает, что если молекула сферическая, то силы, которые на неё действуют – сферические, что указывает на симметрию сил. Если же молекулы не сферические, то возникает асимметрия действующих сил.
z=z(Рпр, Тпр, w)
zсм=z0(Рпр, Тпр)+z1(Рпр, Тпр)×wсм,
где z0 – коэффициент сверхсжимаемости простого газа. Для простого газа молекулы сферические и w=0.
z1 – поправка к коэффициенту сверхсжимаемости непростого газа, который зависит от Рпр, Тпр и w¹0.
wсм – ацентрический фактор всей смеси, характеризуемой определёнными концентрациями:
wсм=Sуi×wi
Отсюда можно видеть, что ацентрический фактор смеси зависит от ацентричного фактора каждого компонента.
уi – молярная концентрация компонента.
37 Плотность природного газа и стабильного углеводородного конденсата
Для природного газа:
rР, t=rР0, t0×(Р×z0×Т0)/(Р0×z×Т)
Для стабильного конденсата:
r(С5+)=1.003×Мк/(Мк+44.29) [кг/см3]
По коэффициенту преломления, определяемого на опыте, можно рассчитать:
1gМк=1.939+0.0019×tк+1g(2.15 - nD),
где tк – температура кипения конденсата; nD – коэффициент преломления.
Эти коэффициенты носят эмпирический характер.
Но плотность стабильного конденсата можно вычислить и по иной формуле, а именно:
rк=Sхi×Мi/Sхi×ni/ri,
где хi – молярная доля i-ого компонента;
ri – плотность i-ого компонента;
Мi – молекулярная масса.
________________________
Плотность газа. Чем больше в газе доля компонентов с высокой молекулярной массой, тем больше молекулярная масса газа, которая линейно связана с плотностью газа:
ρсм = Мсм/22,41
Обычно ρ находится в пределах 0,73 - 1 кг/м3. плотность индивидуальных компонентов углеводородных газов (и сероводорода), за исключением метана, больше 1.
Для характеристики плотности газа используют также ее отношение к плотности воздуха в тех же условиях (плотность воздуха при нормальных условиях составляет 1,293 кг/м3).

где  - относительная плотность газа; ρсм, ρв – плотность газа и воздуха соответственно. Связь между плотностью газа и его молекулярной массой, давлением и температурой определяется законом состояния газов, который можно представить в виде:
- относительная плотность газа; ρсм, ρв – плотность газа и воздуха соответственно. Связь между плотностью газа и его молекулярной массой, давлением и температурой определяется законом состояния газов, который можно представить в виде:
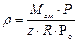
38 Вязкость газа и газовых смесей
Вязкость газов. Вязкость газа зависит от его состава, давления и температуры. Вязкость газов обусловлена обменом количеством движения между слоями газа, движущимися с разными относительно друг друга скоростями. Этот обмен происходит за счет перехода молекул из одного слоя в другой при их хаотическом движении. Так как крупные молекулы обладают меньшей длиной свободного пробега (вероятность их столкновения между собой относительно велика), то количество движения, переносимое ими из слоя в слой, меньше чем небольшими по размерам молекулами. Поэтому вязкость газов с увеличением их молекулярной массы как правило уменьшается.
 С повышением температуры увеличивается скорость движения молекул и соответственно количество движения, переносимое ими из слоя в слой, поэтому при невысоких давлениях вязкость газа с повышением температуры возрастает. При высоких давлениях, когда расстояния между молекулами невелики, несколько меняется передача количества движения из слоя в слой. Она происходит главным образом как и у жидкостей за счет временного объединения молекул на границе слоев, движущихся с разными скоростями. Вероятность такого объединения с ростом температуры уменьшается. Поэтому при высоких давлениях с ростом температуры вязкость газов снижается.
С повышением температуры увеличивается скорость движения молекул и соответственно количество движения, переносимое ими из слоя в слой, поэтому при невысоких давлениях вязкость газа с повышением температуры возрастает. При высоких давлениях, когда расстояния между молекулами невелики, несколько меняется передача количества движения из слоя в слой. Она происходит главным образом как и у жидкостей за счет временного объединения молекул на границе слоев, движущихся с разными скоростями. Вероятность такого объединения с ростом температуры уменьшается. Поэтому при высоких давлениях с ростом температуры вязкость газов снижается.
С увеличением давления вязкость газов возрастает: при низких давлениях незначительно и более интенсивно в области высоких давлений.
Вязкость газа определяют экспериментально, измеряя скорость течения его в капиллярах, скорость падения шарика в газе, затухание вращательных колебаний диска и другими методами. Изменение вязкости при различных давлениях и температурах можно определять расчетным путем и по графикам в зависимости от приведенных давления и температуры.
Вязкость газа при низких давления и температурах близка вязкости идеального газа. Значит, можно воспользоваться кинематической теорией, записав уравнение для разреженного газа:
m=r×v×l/3,
где v – средняя скорость движения молекул; l - длина свободного пробега.
Согласно кинетической теории, вязкость зависит от давления и температуры:
С повышением давления плотность возрастает, но l снижается, следствием чего является возрастание вероятности соударения, средняя скорость движения при этом постоянна, и вязкость в начальный период практически постоянна (Dр<<).
С ростом температуры вязкость возрастает, т.к. увеличивается средняя скорость движения молекул, а плотность и длина свободного пробега практически не меняются.
В то же время из определения вязкости, силы, препятствующие перемещению одного слоя относительно другого должны меняться, а, значит, изменение вязкости носит сложный характер.
 m Рmах
m Рmах
Рmin
T
При малых давлениях m мало зависит от перепада давлений. С ростом давления и увеличением температуры вязкость газов (m) снижается.
Если у нас возрастает молекулярная масса газа, то вязкость увеличится соответственно.
Учёт наличия неуглеводородных газов, их влияние на вязкость проводится следующим образом:
m=уа×mа+(1 – уа)×mу,
где у – молярная доля;
mа – вязкость неуглеводородного газа;
mу – вязкость углеводородного газа.
Зависимость m от молекулярной массы может быть графически изображена:

m
М
39. Зависимость вязкости газа от состава и термобарических условий
См 38
40 Изобарная молярная теплоемкость природных газов
Рассмотрим два основных термодинамических процесса: при постоянном давлении (изобарный) и при постоянном объёме (изохорный).
Для расчёта происходящих процессов в газах применяют понятия изобарной и изохорной удельных теплоёмкостей.
Ср=(dQ/dТ)р
Сv=(dQ/dТ)v
dQ=di - v×dр,
где i- энтальпия идеального газа.
di=dQ+v×dр=Ср×dТ+(v – Т×(dр/dТ)р)dv
При р=соnst: dQ=di=Ср×dТ Þ Ср=(di/dТ)р
Т.о. Ср зависит от температуры.
Сри=0.523×(8.36+0.008×t)mi3/4 [кДж/(кмоль×К)]
Теплоёмкость реальных газов определяется по правилу аддитивности т.е.:
Срсм=Sуi×Срi
Изобарная молярная теплоёмкость зависит от давления и температуры:
Ср=Сри(t)+DСр(р,t),
где DСр – изотермическая поправка теплоёмкости на давление и температуру.
DСр
 Тпр
Тпр
Рпр
Состояния углеводородных систем приобретают особую актуальность, т.к. находятся в области критических состояний, где имеют место фазовые превращения.
Все уравнения, полученные на основе эксперимента, носят полуэмпирический характер.
41 Зависимость изобарной молярной теплоемкости реал газов от давления и темп-ры
См 40
42 Уравнение состояния Пента-Робинсона
43 Уравнение Пента-Робинсона относительно коэф-та сверхсжимаемости
44 Использование ур Пента-Робинсона для описания отклонения тепло-физ свойств газов
Решение задач, относящихся к добыче, транспорту и переработке газа, связано с уравнением Пенга-Робинсона (1975 г.):
Р=R×Т/(v–в)=а(Т)/(v×(v+в)+в×(v-в)),
где а(Т), в – коэффициенты, определяющиеся критическими параметрами, причём а(Т) – некоторая функция.
v – молекулярный объём.
z3 – (1 - В)×z2+(А - 3×В2 - 2×В)×z – (А×В – В2 – В3)=0,
где А=а(Т)×Р/(R2×Т2),
В=в×Р/(R×Т)
Если смесь находится в двухфазном состоянии, то больший корень соответствует фазе пара, а меньший – жидкости.
В критических условиях zкр=соnst – величина постоянная - и zкр=0.307. Тогда:
а(Ткр)=0.45724×R2×Ткр2/Ркр
в(Ткр)=0.0778×R×Ткр/Ркр
Если температура отлична от критической, то эти коэффициент зависят от Ткр:
а(Т)=а(Ткр)×a(Ткр,w);
в(Т)=в(Ткр),
где w - безразмерная функция.
При Т=Ткр a=1.
Связь между a и температурой (Т) можно записать следующим образом:
a0.5=1+m×(1 – Т0.5), m=f(w).
Для смеси уравнение Пенга-Робинсона выглядит так:
асм(Т)=Sуi×аi;
всм(Т)=Sуi×вi,
где аi и вi вычисляются по формулам:
аi=0.457×(R2×Ткрi2/Ркрi)×ai;
вi=0.0778×R×Ткрi/Ркрi
45 Упругость насыщенных паров ув систем и их смесей
46 Закон Генри
Растворимость газов в жидкости. При больших давлениях растворимость газов в жидкости, в том числе и нефти подчиняется закону Генри. Согласно этому закону количество газа Vr, растворяющегося при данной температуре в объеме жидкости Vж, прямо пропорционально давлению газа р над поверхностью жидкости:
Vг = α∙р∙V (2.8)
где [a]=[м2/Н] – коэффициент Генри, учитывающий количество газа, растворяющегося в единице объёма жидкости при повышения давления на единицу.
a=Vг/(Vж×р)
Коэффициент растворимости показывает какое количество газа растворяется в единице объема нефти при увеличении давления на единицу. Коэффициент растворимости газа в нефти — величина непостоянная. В зависимости от состава нефти и газа, температуры и других факторов он изменяется от 0,4∙10-5 до 5∙10-5 1/Па.
В наибольшей степени на растворимость газа в нефти влияет состав самого газа. Легкие газы (азот, метан) хуже растворимы в нефтях, чем газы с относительно большей молекулярной массой (этан, пропан, углекислый газ). В нефтях, содержащих большее количество легких углеводородов, растворимость газов выше по сравнению с тяжелыми нефтями. С ростом температуры растворимость газов в нефти уменьшается.
Из закона Генри следует, что чем больше коэффициент растворимости, тем при меньшем давлении в данном объеме нефти растворяется один и тот же объем газа. Поэтому у нефтей с большим содержанием метана, находящихся при высоких пластовых температурах, обычно высокие давления насыщения, а у тяжелых нефтей с малым содержанием метана при низких пластовых температурах — низкие. С количеством растворенного газа связано различие физических свойств нефти в пластовых условиях и на поверхности.
47 Растворимость газов в нефти и воде
Характеристики растворимости газа в нефти выглядят следующим образом:
 см3/см3
см3/см3
этилен
СО2
СН4
N2
р, МПа
По абсциссе откладываются значения давления, по ординате – количество растворённого в нефти газа.
Растворимость газов возрастает с увеличением молекулярной массы газа. Следовательно, различные компоненты газа обладают различной растворимостью, а, значит, природный газ в природной нефти будет растворяться сложным образом.
Растворимость зависит от состава и свойств нефти. Причём растворимость газов увеличивается с повышением содержания парафиновых углеводородов, а при высоком содержании ароматических углеводородов.
Малорастворимые газы лучше подчиняются закону Генри, чем хорошо растворимые.
На растворимость газов в нефти природа газа влияет в большей степени, чем состав нефти, хотя в сжатом газе при высоких давлениях происходит обратимое растворение компонентов нефти, что видно на выполаживании кривых растворимости хорошо растворимых газов.
Коэффициент растворимости нефтяных газов изменяется в широких пределах и достигает (4-5)×10-5 м3/(м3×Па).
Углеводородные газы хуже растворяются в нефти с повышением температуры.
Кроме процесса растворения, присутствует процесс выделения газа из нефти. Растворение связано с геологическими условиями, причём сам процесс происходил длительный период. А процесс выделения связан с нашей деятельностью, и он уже краткосрочен.
Количество выделившегося газа зависит от выбора технологии:
-газ выделился и находится в контакте с нефтью (газовые шапки);
-газ выделился и мы его вывели из системы нефть-газ (с отводом).
Первый из названных способ дегазации получил название контактного, или одноступенчатого. Второй – дифференциального, или ступенчатого (многократного).
Если процесс дифференциальный, то количество остающегося в растворённом состоянии газе в нефти больше, чем при контактном (одноступенчатом). Это связано с переходом в паровую фазу метана.
48 Изотермы растворимости природных газов в нефтях
Количество выделившегося газа зависит от выбора технологии:
-газ выделился и находится в контакте с нефтью (газовые шапки);
-газ выделился и мы его вывели из системы нефть-газ (с отводом).
Первый из названных способ дегазации получил название контактного, или одноступенчатого. Второй – дифференциального, или ступенчатого (многократного).
Если процесс дифференциальный, то количество остающегося в растворённом состоянии газе в нефти больше, чем при контактном (одноступенчатом). Это связано с переходом в паровую фазу метана.
Количество газа, выделившегося из нефти характеризуется кривыми дегазации. Их получают экспериментально, и для каждого месторождения существует своя кривая.
 см3/см3
см3/см3
Т°; r=соnst
a
р, МПа
Коэффициентом разгазирования принято называть количество газа, выделившегося из единицы объёма нефти при снижении давления на единицу.
Газ может содержаться в растворённом виде и в воде. Причём растворение в обычной воде незначительно, а в минеральной резко повышается (степень минерализации начинает значительно влиять на коэффициент Сеченова при концентрации солей, превышающей 0.5 моль/л). Процессы растворения играли важную роль при миграции углеводородов и формировании залежей.
В каком-то диапазоне давлений разгазирования не происходит.
Если газ разгазируется, то фазовая проницаемость нефти снижается.
49 Контактное и дифференциальное разгазирование нефти
 2 типа кривых разгазирования:
2 типа кривых разгазирования:
1) контактный тип – весь выделившийся газ остается.
2) дифференциальный тип – газ отводится. Характерен для лабораторных условий.
Для диф. Разгазирования – количество газа больше, чем при контактном.
Кривая разгазирования:
+см 47,48
50 Коэффициент разгазирования нефти
Коэффициентом разгазирования принято называть количество газа, выделившееся при снижении давления на единицу.
Кроме нефти, в пласте может находиться большое количество воды.
Содержание растворенного газа в воде выражается в мольных долях.

51 Растворимость ув газов в воде
См 47
52 Давление насыщения нефти газом
53 Как влияют термобарические условия на давление насыщения
Давление насыщения нефти газом – максимальное давление, при котором газ начинает выделяться из нефти в изотермическом процессе, в условиях термодинамического равновесия.
 Кроме всего прочего, давление насыщения зависит от температуры и повышается с её ростом.
Кроме всего прочего, давление насыщения зависит от температуры и повышается с её ростом.
Р, МПа
Т°
Если давление насыщения приблизительно равно пластовому давлению, а мы будем закачивать холодную воду, то пластовая температура снизится, а, значит, газ может выделиться за счёт снижения давления.
Степанова обнаружила, что при очень незначительном выделении газа (сотые проценты) происходит эффект смазки и фазовая проницаемость по нефти аномально возрастает.
Когда мы облучаем породу ультразвуком, начинают выделяться пузырьки газа, контроль над этим процессом позволит регулировать фазовую проницаемость. Количество выделяющихся пузырьков зависит от скелета слагаемой породы, состава пласта. Отсюда можно заключить, что давление насыщения варьируется по пласту.
54 Сжимаемость нефти и характерезующие ее компоненты
Нефть обладает упругостью, которая измеряется коэффициентом сжимаемости (или объёмной упругости).
bн=-1/V×(dV/dр)
Он составляет величину порядка (0.4¼0.7) ГПа-1 (для нефтей, не содержащих растворённый газ). Лёгкие нефти, содержащие значительное количество растворённого газа, обладают повышенным коэффициентом сжимаемости (bн достигает 14 ГПа-1).
bн зависит от температуры и давления, причём чем выше температура, тем больше коэффициент сжимаемости.
 |
b b Т°
40° 120°
Т° Р
Когда нефть из пласта поднимается на поверхность, её состав меня ется, меняется объём.
Объёмный коэффициент рассчитывается по формуле:
в=Vпл/Vдег,
где Vпл – объём нефти в пластовых условиях;
Vдег – объём дегазированной нефти (на поверхности).
 Зависимость объёмного коэффициента от давления выглядит следующим образом:
Зависимость объёмного коэффициента от давления выглядит следующим образом:
В
Рнас Р
Дата добавления: 2015-04-21; просмотров: 463; Мы поможем в написании вашей работы!; Нарушение авторских прав |