
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Вопрос 12. Комплексные соединения: строение, классификация
Комплексные соединения: строение, классификация. Ступенчатая диссоциация комплексных соединений. Математическое выражение константы нестойкости комплексного иона. Виды связей в комплексных соединениях. Механизм образования связей во внутренней сфере (на примерах) по методу валентных связей.
Комплексное соединение – это молекулярные соединения , образующие комплексные ионные , в которых имеется хотя бы одна связь , образованная по донорно –акцепторному механизму ,и способные к существованию как в растворе , так и в кристалле. В комплексных соединениях различаются внутреннюю и внешнюю сферы ,например :
| тип гибридизации | Геометрическая форма | Угол между связями | Примеры |
| sp | линейная | 180o | BeCl2 |
| sp2 | треугольная | 120o | BCl3 |
| sp3 | тетраэдрическая | 109,5o | CH4 |
| sp3d | тригонально-бипирамидальная | 90o; 120o | PCl5 |
| sp3d2 | октаэдрическая | 90o | SF6 |
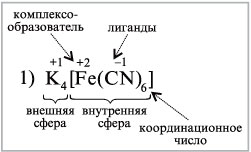
Между внутренней и внешней сферой реализуется ионная связь , а во внутренней сфере –ковалентная . Внутренняя сфера от внешней отделена при написании квадратными скобками .
Комплексообразователь – центральный атом или ион во внутренней сфере комплексного соединения . обычно в качестве комплексного- образователя выступают ионы d и f элементов (переходных металлов) Fe , Ag, Au, Cu ,Zn, Co , Ni , и др .Комплексообразователь располагают в центре схемы комплексного соединения .
Координациионное число комплексообразователя- число монодентатных лигандов , распложенных около центрального атома . 95 % всех комплексных соединений имеют КЧ 4 и 6 . Интересно отметить что в природе чаще встречаются координационные соединения с нечетными КЧ . В зависимости от КЧ молекулы комплексов имеют определенную геометрическую конфигурацию – линейную , плоскую , тетраэдрическую , октаэдрическаю и др .
Кратность связи – это число электронных пар, которые осуществляют связь между атомами . чем выше кратность , тем прочнее связь
Лиганды (L)- нейтральные молекулы или ионы , которые координированы вокруг комплексообразователя , например: а) нейтральные молекулы – NH3 . H2O . CO
б ) ионы :Cl ̄ , Br ̄ , I ̄ , CN ̄ , SO4 ̄
Лигандами могут быть:
а) полярные молекулы – NH3, Н2О, CO, NO;
б) простые ионы – F–, Cl–, Br–, I–, H–, H+;
в) сложные ионы – CN–, SCN–, NO2–, OH–
характеристика лигандов является дентатность – количество связей , которыми лиганд связан с комплексообразователем . Существует моно – и мультидентатные лиганды .
константа нестойкости - константа диссоциации комплексного иона . комплексные ионы являются слабыми электролитами и диссоциируют ступенчато , для каждой ступени можно записать выражение константы диссоциации ,
1 ступень (Cu(NH3)4)+2 --- ( Cu(NH3)3)+2 +NH3
2 СТУПЕНЬ (Cu(NH3)3)2+ ---(Cu(NH3)2)2+ + NH3
3 ступень (Cu(NH3)2)2+ ---(Cu(NH3)2+ + NH3
4 ступень (Cu(NH3)2+ ---Cu2+ + NH3
K= 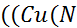 H3)4)2+) * (NH3) / (Cu(NH3)4)+2 и так для каждой ступени)
H3)4)2+) * (NH3) / (Cu(NH3)4)+2 и так для каждой ступени)
Дата добавления: 2015-04-18; просмотров: 325; Мы поможем в написании вашей работы!; Нарушение авторских прав |