
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Вопрос 13. Гибридизация атомных орбиталей при образовании химической связи
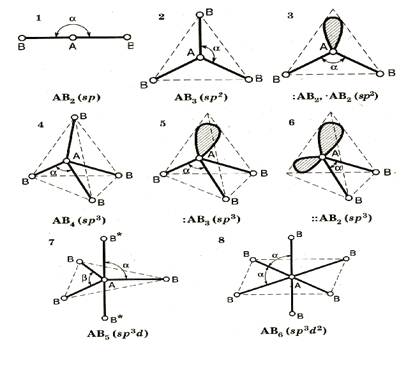
Гибридизация атомных орбиталей при образовании химической связи. Типы гибридизации. Пространственная структура и полярность молекул (на примерах BeF2, BCl3, CH4, NH3 и комплексных ионов [Cu(NH3)4]2+, [Zn(NH3)4]2+.
Гибридизация атомных орбиталей – перераспределение электронных плотностей близких по энергии орбиталей . которое приводит к их равноценности . из разных по форме и энергии атомных орбиталей образуется гибридные . эти орбитали с неравномерно распределенной электронной плотностью ,одинаковы по форме и энергии , причем их ориентация в пространстве отличаются от ориентации исходных . они имеют форму , близкую к неправильной объемной восьмерке
Главное преимущество гибридных орбиталей – более глубокое перекрывание с орбиталями соединяющих атомов ,образование более прочных связей , что проводит к более выгодному низкому энергетическому состоянию образовавшейся молекулы . гибридизация требует затрат энергии , компенсировать которую может только химическая реакция.
Дата добавления: 2015-04-18; просмотров: 259; Мы поможем в написании вашей работы!; Нарушение авторских прав |