
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Если в равновесной системе, полученной в результате взаимодействия графита с СО2, увеличить давление, то как изменится состав газовой фазы?
С+ СО2=2СО
Запишем константу равновесия для реакции Сгр+СО2=2СО:
Ка= (aCО2 /aС*aСО2)равн, т.к аС=1(графит), то можно записать для газов: Ка=(РСО2/РСО2)равн.
Т.к. РСО=Р*(%СО/100) и РСО2=Р*(%СО2/100), то Ка=Р*%СО2/(100*%СО2)равн.
При увеличении давления равновесие будет смещаться в сторону уменьшения числа молей газа, то есть вправо.
Изменение величин скомпенсировано таким образом, что числовое значение константы постоянно.
59. Если в систему ввести Fe и Fe2O3 при 1083 К, то из каких фаз будет состоять система и каков может быть состав конденсированных фаз? От чего будет зависеть этот состав? (336-347) Есин, Гельд Ф-Х ч.1(см. Невидимов 90%)
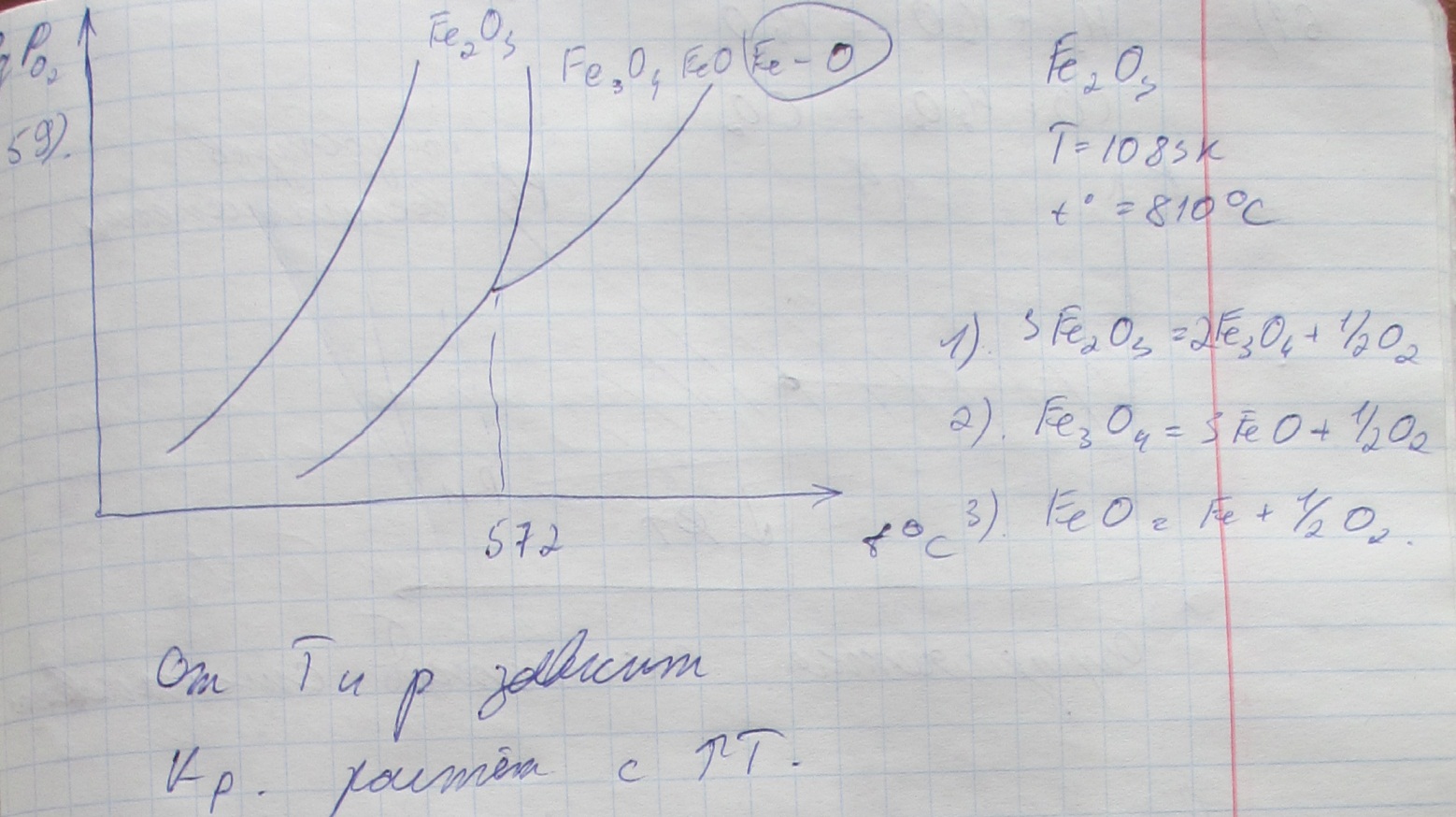
В равновесной системе находятся Fe2O3 и Fe3O4 в твёрдом виде. Какими путями можно обеспечить практически полное исчезновение Fe2O3, не меняя температуры? (см. Невидимов 90%)(336-347) Есин, Гельд Ф-Х ч.1
Аналогично вопросу 59 и уменьшить давление О2
Какие факторы влияют на скорость диссоциации твёрдого карбоната кальция? Можно ли при более низкой температуре получить более высокую скорость диссоциации? (см. Невидимов 90%)(336-347) Есин, Гельд Ф-Х ч1
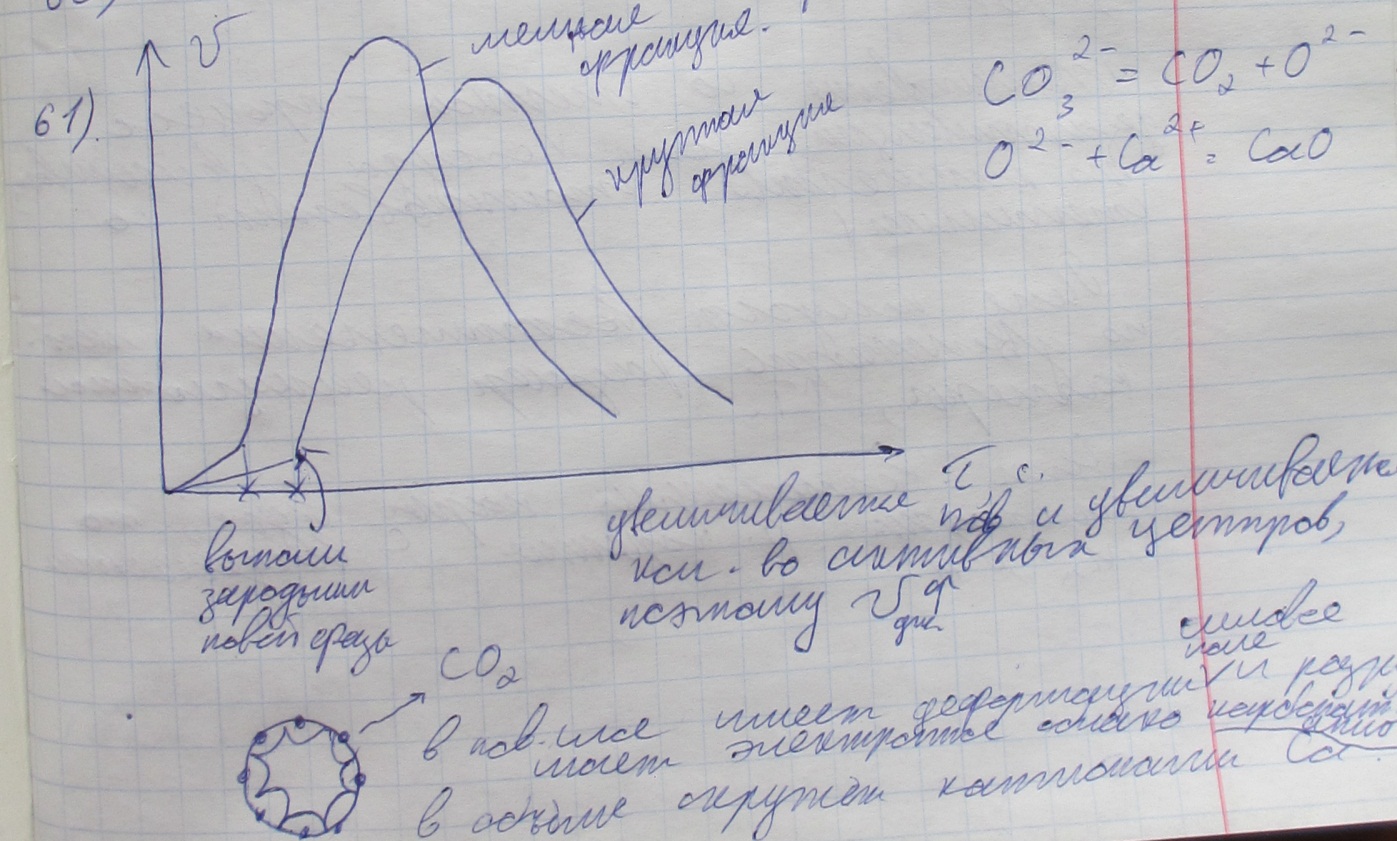
Увеличивается поверхность и увеличивается количество активных центров, поэтому скорость диссоциации увеличивается.
В поверхностном слое имеются деформации (силовое поле разрушает электронное облакокарбонат-аниона. Который в объёме окружён катионами Са)
Если в систему ввести СО и СО2 в заданном соотношении, то введением каких веществ и за счет каких реакций можно менять это соотношение при постоянной температуре? В какую сторону нужно менять температуру, если это соотношение необходимо увеличить?
Рассмотрим 3 реакции:
1) С+CO2=2CO
2) 2CO+O2=2CO2
3) MeO+CO=Me+CO2,
Соотношение будет меняться при постоянной температуре, если компоненты С и MeO будут представлены при температуре выше температуры кипения.
Активности реагирующих компонентов связаны между собой определенным соотношением, которое является выражением закона действующих масс. При равновесии такая дробь, числитель которой есть произведение активностей образующихся при реакции веществ, а знаменатель- произведение активностей исходных веществ, есть величина постоянная и называется константой равновесия Ка:
Ка= aC/aA*aB2
Показателями степеней при активностях являются стехиометрические коэффициенты, в которых данные вещества вступают в реакцию.
Константа равновесия зависит от температуры и природы реакции и не зависит от давления и концентрации реагентов.
Смещение равновесия реакции можно определить, используя принцип Ле-Шателье, согласно которому: если на систему, находящуюся в равновесии оказать внешнее воздействие, то равновесие сместится т.о., чтобы уменьшить внешнее воздействие. Однако, используя константу равновесия, можно также определить смещение равновесия реакции Сгр+СО2=2СО с повышением температуры.
Запишем константу равновесия для реакции Сгр+СО2=2СО:
Ка= (aCО2 /aС*aСО2)равн, т.к аС=1(графит), то можно записать для газов: Ка=(РСО2/РСО2)равн.
Т.к. РСО=Р*(%СО/100) и РСО2=Р*(%СО2/100), то Ка=Р*%СО2/(100*%СО2)равн.
Согласно уравнению изобары химической реакции (∂lnKa/∂T)P=ΔH0/RT2 с увеличением температуры константа равновесия должна возрастать, следовательно (%СО)↑ , а (%СО2)↓. Таким образом, с увеличением температуры равновесие реакции сместится вправо (в сторону увеличения %СО и уменьшения %СО2).
Дата добавления: 2015-04-18; просмотров: 369; Мы поможем в написании вашей работы!; Нарушение авторских прав |