
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Отклонения реальных газов от физических законов
Законы газового состоянии справедливы для идеальных газов. Все существующие в действительности реальные газы более или менее отклоняются от идеальных газов. При этом отклонение тем больше, чем ниже температура и выше давление.
Такие газы, как водород, азот, кислород, так называемые действительные или постоянные газы при обычных условиях приближаются к идеальным. Вообще при нормальных температурах и давлении отклонение от идеальных газов меньше у тех газов, у которых критическая температура очень низка, а критическое давление велико. Для таких газов почти полностью справедливо выражение PV=const. Реальные газы следуют этому закону приблизительно и то при низких давлениях. Для реальных газов уравнение состояния газа PV=RT является предельным, т. е. становится справедливым только при Р→0.
Причина отклонения реальных газов от законов газового состояния заключается в следующем.
Законы газового состояния были введены при допущении, что молекулы газа можно рассматривать как материальные точки, размep которых ничтожно мал по сравнению с пространством между ними, и что между молекулами газа не действуют межмолекулярные силы. Между тем у реальных газов молекулы занимают некоторый объем, вследствие чего часть объема занята самими молекулами, и между ним действуют силы сцепления.
Было сделано много попыток опытным путем или теоретически обобщить отклонения реальных газов от законов газового состояния. Из всех попыток наибольшего внимания заслуживает уравнение Ван-дер-Ваальса, согласно которому в уравнение состояния газа PV=RT введены поправки на объем, занимаемый молекулами, и на силы взаимодействия между ними (внутреннее давление). Уравнение, Ван-дер-Ваальса имеет следующий вид
 (1.14)
(1.14)
где  - выражает внутреннее давление молекул, которое является равнодействующей сил их взаимного притяжения в объеме V; b - поправка на объем, которая при допущении шарообразности молекул равна учетверенному объему самих молекул.
- выражает внутреннее давление молекул, которое является равнодействующей сил их взаимного притяжения в объеме V; b - поправка на объем, которая при допущении шарообразности молекул равна учетверенному объему самих молекул.
Постоянные а и b приведенного уравнения могут быть вычислены из критических условий по следующим соотношениям:
 ;
;
 ;
;
 .
.
Если вместо параметров Р, V и Т ввести приведенные параметры и выразить константы aи bчерез критические параметры, то уравнение (1.14) может быть преобразовано в обобщенное уравнение, одинаковое для любого газа:

где  — приведенные давление, объем и температура
— приведенные давление, объем и температура
Уравнение состояния газов Baн-дep-Ваальса наиболее точно определяет поведение легких газов при давлении до 100 атм и температуре 0-200С. Применение этого уравнения к пропану и бутану или их смесям в назначенном диапазоне температур и давлений приводит к ошибкам, величина которых не превышает 10%.
Однако уравнение Ван-дер-Ваальса громоздко и пользоваться им при термодинамических расчетах трудно. Значительно удобнее и легче пользоваться уравнением состояния идеального газа, введя в него эмпирическую безразмерную поправку:
PV = zRT
Откуда

Безразмерный поправочный коэффициент z называется коэффициентом сжимаемости газов.
Эта эмпирическая величина, выражающая отклонение реальных газов от идеальных, находится из специальных графиков, построенных по приведенным температурам и давлениям.
Коэффициент сжимаемости в согласовании с законом соответствующих состояний связан с критическими и приведенными параметрами. Так как согласно уравнению (1.13)
 ,
,
то можно записать
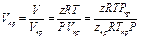 .
.
Откуда
 (1.15)
(1.15)
Если уравнение (1.15) написать в выражениях критических параметров, то получим значение критического коэффициента сжимаемости, т. е. значение коэффициента сжимаемости для критической точки
 ,
,
Для абсолютного большинства веществ значение Zкр лежит в пределах 0,25—0,29, а в среднем принимается равным около 0.265
Отклонение газов от законов газового состояния при нормальных условиях может быть определено по уравнению
 ,
,
где ρ0 - плотность при нормальных условиях, определенная экспериментально.
Зная коэффициент сжимаемости при нормальных условиях, можно определить его значение и при любых других условиях по уравнению:
 .
.
Процессы сжатия и расширения газа
Изменение состояния газа в зависимости от условий может происходить различно, причем каждый комплекс условий определяет соответствующий процесс изменения состояния газа.
Изменение состояния газа может происходить без теплообмена с окружающей средой (обычно это бывает при очень быстром течении процесса, например при движении газа в сопле реактивного двигателя). Такой процесс называется адиабатным и характеризуется уравнением: рVк = const, откуда следуют такие соотношения:



где k = cp/cw- показатель адиабаты; ср - теплоемкость газа при р = const; cw-теплоемкость газа при V= const.
Все перечисленные выше процессы являются частными случаями по-литропного процесса, при котором ни один параметр газа не остается неизменным и состояние газа изменяется в условиях теплообмена с окружающей средой. Он характеризуется соотношением рVn = const, откуда следуют равенства:
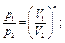


где п - показатель политропы.
При п = k - получим адиабатный процесс, при n = 1 - изотермический, при п = 0 - изобарный, при п = ∞- изохорный.
Дата добавления: 2015-04-18; просмотров: 487; Мы поможем в написании вашей работы!; Нарушение авторских прав |