
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Закон Рауля
Углеводородные жидкости образуют друг с другом так называемые идеальные растворы, т. е. растворы, в которых компоненты полностью растворимы. Растворение газа в жидкости происходит до тех пор, пока парциальное давление газа не сравняется с парциальным давлением жидкости. Этот момент равенства парциальных давлений соответствует так называемому равновесному состоянию (равновесию фаз).
Французский химик Франсуа Мари Рауль (1830—1901) установил, что парциальное давление pt любого компонента в жидкой смеси равно молекулярной концентрации его в жидкости хi , умноженной на упругость его паров θi в чистом виде при данной температуре, т. е.
 .
.
Общее давление или упругость паров жидкости Р, состоящей из нескольких компонентов, равно сумме парциальных давлений этих компонентов
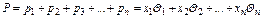 .
.
При равновесии фаз, т. е. когда парциальное давление компонента в паровой фазе (над жидкостью) и в жидкой фазе (в жидкости) будут одинаковы, закон Рауля примет следующий
вид:
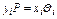 .
.
где 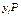 —парциальное давление в паровой (газовой) фазе (согласно закону Дальтона);
—парциальное давление в паровой (газовой) фазе (согласно закону Дальтона); 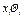 — парциальное давление в жидкой фазе (согласно закону Рауля).
— парциальное давление в жидкой фазе (согласно закону Рауля).
Зная состав жидкой смеси, по приведенному уравнению равновесия фаз легко определить состав пара, находящегося в равновесии с нею:
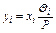 ,
,
или состав жидкой смеси
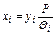 .
.
Из приведенного уравнения следует, что
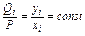
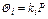
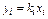
Константы равновесия k отдельных компонентов зависят от температуры и давления и берутся, как правило, из специально составленных графиков. Применение сжиженного газа, его транспортирование и хранение основаны на законе Рауля.
Дата добавления: 2015-04-18; просмотров: 247; Мы поможем в написании вашей работы!; Нарушение авторских прав |