
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Сутність і природа водневого зв'язку
Першу наукове трактування водневого зв'язку дали в 1920 році В. Латімер і В. Родебуш, що працювали в лабораторії Г. Льюїса, основоположника вчення про ковалентного зв'язку, автора теорії кислот і основ і плідною в органічній хімії концепції узагальненої електронної пари. Причину особливих фізичних і хімічних властивостей води автори пояснювали наявністю водневого зв'язку, сутність якої полягає у взаємодії атома водню однієї молекули з електронною парою атома кисню іншої молекули. При цьому атом водню стає одночасно пов'язаним з двома атомами кисню ковалентного і водневої зв'язком:
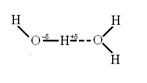
За весь наступний час аж до наших днів не змінився принциповий підхід до трактування водневого зв'язку, концепція неподіленого протона залишилася непорушною. Тривалі та інтенсивні дослідження дозволили уточнити вплив структури з'єднань на схильність до утворення Н-зв'язків, внесена певна ясність в електронну природу останніх, знайдені надійні методи їх ідентифікації. А головне - зроблені широкі узагальнення з оцінки впливу Н-зв'язків на фізичні і хімічні властивості речовин.Бутлеровскій теза "структура визначає властивості" розкривається з урахуванням можливості утворення Н-зв'язку та її внеску в конкретні властивості. Нижче представлений підсумковий матеріал з вивчення питань, пов'язаних з проблемою водневого зв'язку.
Перш ніж викласти сучасний погляд на природу сил, що обумовлюють утворення водневих зв'язків, відзначимо найважливіші експериментальні факти, які супроводжують цей процес.
I. При утворенні водневих зв'язків виділяється теплота - термохімічна міра енергії Н-зв'язку. Цю характеристику використовують для калібрування спектральних методів вивчення водневих зв'язків.
II. Відстань між сусідніми атомами, які беруть участь в утворенні водневого зв'язку, значно менше суми їх ван-дер-ваальсових радіусів. Так, у воді відстань між атомами кисню в системі О-Н ... О становить 0,276 нм. Якщо прийняти, що довжина ковалентного зв'язку О-Н дорівнює 0,1 нм, то довжина зв'язку Н ... О складе 0,176 нм, тобто вона значно (приблизно на 70%) длиннее ковалентного зв'язку між цими атомами. Проте зв'язок Н ... О виявляється значно коротше суми ван-дер-ваальсових радіусів, що становлять для водню і кисню відповідно 0,12 і 0,14 нм. Остання обставина є од-
ним із критеріїв, що вказують на освіту між молекулами водневих зв'язків.
III. Водневий зв'язок збільшує довжину зв'язку Х-Н, що призводить до зміщення відповідної смуги валентних коливань в ІЧ-спектрі в бік більш низьких частот. Метод ІЧ-спектроскопії є головним методом вивчення водневого зв'язку.
IV. При утворенні водневого зв'язку полярність зв'язку Х-Н зростає, що приводить до підвищення дипольного моменту молекулярного комплексу в порівнянні з розрахунковими даними, отриманими шляхом векторного додавання диполів молекул RXH і BY.
V. Протони, що беруть участь в водневого зв'язку, характеризуються нижчою електронної щільністю, тому вони деекраніруются, що призводить до істотного зсуву відповідних резонансних сигналів у спектрах ЯМР 1 Н в слабке поле.Протонний магнітний резонанс поряд з ІЧ-спектрами є найбільш чутливим до утворення Н-зв'язку.
 VI. Для міжмолекулярних водневих зв'язків виявлено зсув кислотно-лужної рівноваги молекулярний комплекс іонна пара вправо при підвищенні полярності розчинника.
VI. Для міжмолекулярних водневих зв'язків виявлено зсув кислотно-лужної рівноваги молекулярний комплекс іонна пара вправо при підвищенні полярності розчинника.
Дата добавления: 2015-04-18; просмотров: 321; Мы поможем в написании вашей работы!; Нарушение авторских прав |