
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Водневі зв'язку з властивості органічних сполук
Водневий зв'язок виникає при взаємодії кислотних Х-Н та основних В груп, що належать одній або різним молекулам.При об'єднанні однакових молекул утворюються асоціати, об'єднання різних молекул прийнято називати молекулярними комплексами (Н-комплексами). Такі взаємодії складають самий великий клас Н-зв'язків, званих міжмолекулярними водневими зв'язками. Міжмолекулярні взаємодії не обмежуються утворенням бінарних комплексів, а можуть приводити до структур з множинними зв'язками (вода, фтористий водень, спирти, феноли, аміди, поліпептиди, білки). Міжмолекулярні водневі зв'язки можуть призводити до утворення ланцюгів, кілець або просторових сіток. Аналогічні освіти зберігаються і в кристалах.
Якщо Н-зв'язування настає в результаті взаємодії кислотного і основного фрагментів всередині однієї молекули, то утворюються зв'язку називають внутрішньомолекулярними. З'єднання з такими зв'язками складають іншу велику групу сполук з водневим зв'язком. Природно, що утворення внутрішньомолекулярних водневих зв'язків можливо, якщо структура молекули допускає просторове зближення фрагментів Х-Н і В до довжини водневого зв'язку. Можливість утворення внутрішньомолекулярної водневого зв'язку не є перешкодою для освіти і міжмолекулярних водневих зв'язків. Як приклад розглянемо ізомерні орто-і парагідроксібензальдегіди. Саліциловий альдегід (орто-ізомер) здатний до утворення як внутрішньо-, так і міжмолекулярних водневих зв'язків, тоді як для пара-ізомеру положення взаємодіючих груп допускає освіту тільки міжмолекулярних водневих зв'язків
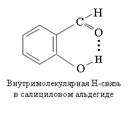

Експериментально досить легко відрізнити внутрішньомолекулярні водневу зв'язок від міжмолекулярної. Якщо спектрально фіксується освіта Н-зв'язків, а ознак асоціації ні, це вірне вказівку на внутрішньомолекулярні характер водневого зв'язку. Крім того, міжмолекулярних Н-зв'язок (і її спектральне прояв) зникає при низькій концентрації речовини в нейтральному розчиннику, тоді як внутримолекулярная Н-зв'язок у цих умовах зберігається.
Водневі зв'язки впливають на перерозподіл електронної щільності в молекулах, що не може не відбитися на властивості речовин. У разі слабких водневих зв'язків зміна електронної щільності протікає в основному в межах фрагмента Х-Н ... В. Зі збільшенням енергії водневого зв'язку перерозподіл електронної щільності зачіпає всі атоми молекул, що входять в молекулярний комплекс, що в кінцевому підсумку призводить до глибоких змін фізичних і хімічних властивостей речовин. На властивості органічних сполук роблять значний вплив як внутрішньо-, так і міжмолекулярні водневі зв'язки. Вплив останніх, особливо на фізичні властивості, є більш суттєвим, так як міжмолекулярні взаємодії призводять до збільшення молекулярної маси з усіма витікаючими наслідками.
Тепер спробуємо орієнтовно оцінити, наскільки широко представлені водневі зв'язки в органічній хімії. Всі органічні сполуки за самим рідкісним винятком містять водень, тобто є кислотами Бренстеда, а найбільш часто входять до їх складу елементи-органогени (O, N, S, галогени) містять неподілені пари електронів і можуть виступати в якості основних центрів. Враховуючи зазначене, можна сказати, що більшість органічних сполук потенційно здатне до утворення водневих зв'язків. За структурною формулою (природа взаємодіючих груп і їх взаємне розташування) можна передбачити силу водневих зв'язків та їх характер (внутрішньо-чи міжмолекулярні). При оцінці взаємного впливу атомів в молекулах обов'язково враховуються можливість утворення водневих зв'язків та їх подальший вплив на швидкість, механізм і напрямок реакцій. Оцінити вплив середовища (розчинника) на хід хімічного процесу часто стає можливим лише з урахуванням утворення водневих зв'язків. Таким чином, підготовка грамотного хіміка неможлива без оволодіння всім комплексом питань, пов'язаних з водневим зв'язком.
Розглянемо декілька найбільш характерних прикладів впливу водневих зв'язків на властивості органічних сполук. Перш за все це так звані прототропние процеси - перетворення, пов'язані з перенесенням протона. Відомо, що енольних структури (гідроксильна група знаходиться при вуглеці з кратною зв'язком = С-ОН) є нестійкими і в органічній хімії часто такі формули беруть у квадратні дужки як вказівку на їх нереальність, гіпотетичність. У той же час β-дикетонами та інші 1,3-дікарбонільние сполуки здатні існувати у двох формах: кетони та енольной. Для ацетооцтового ефіру ці перетворення можуть бути представлені схемою

Освіта енергетично менш вигідною енольной форми пояснюється як формуванням системи зв'язаних зв'язків С = С-С = О, що завжди є стабілізуючим фактором, так і тією обставиною, що між енольними гідроксилом і карбонільним киснем утворюється внутримолекулярная воднева зв'язок, що знижує вільну енергію енольной форми як шляхом "закріплення" атома водню у більш електронегативного елемента, так і в результаті подовження ланцюга сполучення (Н-зв'язок включена в кругову ланцюг сполучення). З урахуванням водневих зв'язків не тільки пояснюють реальність енольной структури, а й кількість цієї форми в таутомерних системі. На стан кето-енольной рівноваги великий вплив робить природа розчинника. Максимальна кількість енольной форми відзначається в нейтральних неполярних розчинниках (вуглеводні). У водних розчинах кількість енольной форми незначно, так як вода конкурентно утворює з карбонільним киснем міжмолекулярні водневі зв'язки, руйнуючи стабілізуючі енольной форму внутрішньомолекулярні водневі зв'язки.
Карбонові кислоти, як і спирти, можуть брати участь в утворенні Н-зв'язків як в ролі Н-донорів, так і Н-акцепторів. У першому випадку кислотність знижується, у другому зростає. Це яскраво проявляється при іонізації двоосновний кислот: перша константа дисоціації (K 1) аномально велика, а друга (K 2) аномально мала. Для пояснення спостережуваних експериментальних результатів крім електронних ефектів велика роль надається вкладом Н-зв'язків. У вихідній структурі Н-зв'язок сильно активує карбоксильну групу, що виступає в ролі Н-акцептора. У утворився на першій стадії дисоціації моноаніоне утворюється міцна внутримолекулярная Н-зв'язок, різко знижує кислотність другий карбоксилу:

Для карбонових кислот характерне утворення Н-комплексів і асоціатів псевдоцікліческой структури:

Міжмолекулярні зв'язки, що виникають між молекулами карбонових кислот, настільки міцні, що навіть у газоподібному стані димерную структури частково зберігаються. До речі, освіта димера карбонової кислоти допомагає дати відповідь на давнє запитання, що більшою мірою визначає міцність водневого зв'язку - кислотність групи Х-Н або основность фрагмента В. Оцтова кислота (pK a = 4,7) по кислотності на кілька порядків поступаючись трихлороцтової ( pK a = 0,6), тим не менш утворює більш міцний димер. Основність протоноакцептора має пріоритет перед кислотністю протонодонора.
Відомо, що гемінальние дігідроксіпроізводние є нестабільними сполуками - дегідратіруясь легко перетворюються на відповідні альдегіди чи кетони. Хлоральгідрат є одним з небагатьох прикладів, коли структура гем-Діола є стабільною. І причину цього пояснюють як сильним негативним індукційним ефектом (-I-ефект) тріхлорметільной групи, так і наявністю внутрішньомолекулярних Н-зв'язків:

Освіта внутрішньо-і міжмолекулярних водневих зв'язків може істотно впливати на хід та швидкість хімічних реакцій. На жаль, незважаючи на значну кількість робіт, присвячених цьому питанню, широких узагальнень, які мали б передбачувану силу, не було. У найзагальніших рисах показано, що швидкість реакцій може зменшуватися або збільшуватися залежно від того, як при утворенні Н-зв'язку буде перерозподілятися електронна щільність в реакційних центрах молекули. Такі питання, як природа проміжних продуктів або активованого комплексу, зміна термодинамічних функцій, вплив сусідніх груп, не отримали належного розвитку. Більш визначено дана оцінка ролі розчинника.
Відомо багато емпіричних підходів. Так, в реакціях алкілування сполук, що містять зв'язку О-Н, S-H, N-H, введення в реакційне середовище фториду калію (фторид-аніон F-є найефективнішим протоноакцептором) значно збільшує швидкості реакцій і виходи продуктів алкілування. Велика роль водневим зв'язкам відводиться в реакціях, що проводяться в розчинниках, здатних утворювати Н-зв'язки як з вихідними сполуками, так і з продуктами їх взаємодії.
Дата добавления: 2015-04-18; просмотров: 409; Мы поможем в написании вашей работы!; Нарушение авторских прав |