
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Внутренняя энергия термодинамической системы
Термодинамика изучает количественные закономерности превращения энергии, обусловленные тепловым движением молекул. Основу термодинамики составляют два фундаментальных закона, являющиеся обобщением многовекового опыта человеческой деятельности и называемых началами термодинамики. Первое начало описывает количественную и качественную стороны процессов превращения энергии; второе начало позволяет судить о направлении этих процессов.
Одним из основных понятий термодинамики является внутренняя энергия.
Под внутренней энергией U в термодинамикепонимают энергию теплового движения частиц, образующих систему, и потенциальную энергию их взаимного положения.
Для идеального газа потенциальная энергия взаимодействия молекул считается равной нулю, и внутренняя энергия идеального газа представляет собой только кинетическую энергию теплового движения. Поэтому внутренняя энергия одного моля идеального газа равна:

| (8.1.1) |
внутренняя энергия для ν молей:

| (8.1.2) |
Из формулы (8.1.1) видно, что внутренняя энергия идеального газа пропорциональна абсолютная температуре.
Внутренняя энергия обладает следующими свойствами:
– в состоянии теплового равновесия частицы системы движутся так, что их полная энергия все время равна внутренней энергии;
– внутренняя энергия – величина аддитивная, т.е. внутренняя энергия системы тел равна сумме внутренних энергий образующих систему тел;
– внутренняя энергия системы является однозначной функцией ее состояния, т.е. каждому состоянию системы присуще только одно значение энергии; это означает, что изменение внутренней энергии при переходе из одного состояния в другое не зависит от пути перехода. Величина, изменение которой не зависит от пути перехода в термодинамике называется функцией состояния: DU=U2–U1 не зависит от вида процесса, или
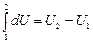 , ,
|
где U2 и U1 – значения внутренней энергии в состояниях 1 и 2. Здесь dU – полный дифференциал. Изменение внутренней энергии системы может произойти, если: 1) система получает извне или отдает окружающим телам некоторую энергию в какой-либо форме; 2) система совершает работу против действующих на нее внешних сил.
Дата добавления: 2015-02-09; просмотров: 298; Мы поможем в написании вашей работы!; Нарушение авторских прав |