
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Основы термодинамики процессов жизнедеятельности.
Существование любого живого организма связано с непрерывным обменом вещественным, энергетическим и информационным с окружающей средой. Энергия, приходящая в систему расходуется на синтез биоэнергетических соединений на поддержание химических, астматических и электрических потенциалов, а так же их градиентов. В процессе жизнедеятельности происходит непрерывное превращение одних видов энергии в другие. Необходимо использовать термодинамику, как науку изучающую наиболее общие закономерности превращений различных видов энергии.
Термодинамической системой называется часть пространства с материальным содержанием, ограниченная некоторой оболочкой. Состояние системы характеризуется параметрами.
Экстенсивные параметры зависят от общего содержания вещества( масса или объем системы).
Интенсивные параметры не зависят от количества вещества в системе и стремится к выравниванию( температура, давление).
Возможно 3 вида термодинамических систем: изолированные, замкнутые и открытые.
Изолированные не могут обмениваться с окружающей средой ни энергией, ни веществом. Со временем такая система приходит в равновесное состояние, при котором все параметры одного значения. Такому состоянию соответствует наименьшее значение термодинамических потенциалов и максимальное значение энтропии.
Замкнутая система может обмениваться с окружающей средой веществом и информацией.
В открытой системе происходит обмен происходит обмен с окружающей средой веществом, энергией и информацией. Она может находится в стационарном состоянии. Стационарным называется состояние при котором параметры системы
могут принимать в разных точках системы разные значения, которые не изменяются по времени. Изменение любого параметра, приводят к изменению состояния системы. Переход из одного состояния в другое- процесс. Процесс называется обратимым, если система возвращается в исходное состояние через одни и те же состояния, что и в прямом направлении. Необходимым называется процесс, протекающий только в одном направлении. Характеристикой состояния системы являются термодинамические потенциалы. Внутренняя энергия равна сумме всех видов энергии частиц, их которых состоит система, за исключением кинетической и потенциальной энергии системы, как целого. Внутренняя энергия- функция состояния и определяется параметрами системы.
Рассмотрим взаимодействия системы с окружающей средой. Обмен энергией может происходить за счет количества теплоты и совершенствования системной работы. Количество теплоты- теплообмен. 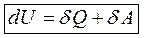
Процесс изменения энергии зависит от вида процессов, от способа совершения работы или передачи теплоты. Существуют следующие способы совершения работы:
1. Механическая работа при перемещении тел. 
2. Механическая работа при расширении газа. 
3. Работа по переносу электрического заряда. 
4. Работа при химических реакциях. 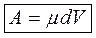
В обобщенном виде: 
Если на систему действует несколько сил, то по 1-му закону термодинамики: 
Работа связана с превращением различным видом энергии. Подразделяется несколько видов энергии по способности их превращения в другие виды:
1. А- максимальная эффективная энергия. К ней относятся: гравитационная, световая, ядерная.
2. В- химическая энергия может превращаться в тепловую и электрическую энергию.
3. С- тепловая энергия. Деградация высших форм энергии в низшие, основное эволюционное свойство изолированных систем.
Тепловая энергия- это особый вид энергии низшего качества, который не может переходить без потери в другие виды энергии, т.к. тепловая энергия связана с хаотическим движением молекул. Живые организмы не являются источником новой энергии. Окисление поступающих в живой организм веществ приводит к высвобождению в нем эквивалентного хождения энергии, связанных с химической формой или каким-то другим видом энергии. Важной характеристикой системы является термодинамический потенциал. Существует 4 потенциала:

Функции состояния, изменение которых дает определить выполнение полезной работы и количество теплоты поступления в систему при теплообмене, по знаку и величине потенциала, можно следить по направлению процесса, при достижении равновесия, термодинамический потенциал стремится к наименьшему значению.
1)  2)
2) 
3) 
Изменение энтальпии учитывает тепловой эффект химической реакции.
4) Термодинамический потенциал Гиббса.

Т.о. изменение потенциалов характеризует работу всех видов сил производной системы и количество теплоты которой обменивается система с окружающей средой. Различают 4 способа теплообмена:
1. Теплопроводность связанная с переносом теплоты через ткани организма, связанные с законом Фурье:
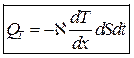
2. Конвекция, количество теплоты, которое переносится потоками разной плотности и разной температуры. 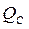 .
.
3. Излучение, возникает на границе системы в виде электромагнитных волн, закон Стефана-Больцмана:
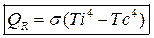
Ti- собственная температура
Tc- температура среды
4. Испарение, связано с превращением вещества из жидкого состояния в газообразное.

С учетом всех видов теплообмена можно записать уравнение теплового баланса:
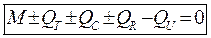
Процессы теплообмена могут как увеличивать, так и уменьшать теплоту энергии, за исключением энергии испарения, которая всегда уменьшает количество теплоты внутри системы. Поскольку организм является термостатической системой, то для поддержания внутри организма постоянной температуры не зависит от внешних условий, организм имеет многочисленные системы регуляции.
Химическая регуляция происходит за счет изменения окислительных процессов внутри организма. Однако, изменение интенсивности обмена веществ приводит к серьезным нарушениям жизнедеятельности организма.
Физическая терморегуляция позволяет изменять интенсивность теплопроводности, конвекции и испарения. Терморегуляция внутренних органов, в которых в основном происходит выделение теплоты, совершенствуется при помощи тока крови, которая обладает высокой теплопроводностью. Интенсивность процесса теплообмена регулируется за счет усиления или ослабления оттока крови и связано с расширением или сужением кровеносных сосудов и является ответом на изменение внешних условий. Если температура среды выше температуры тела, то дополнительная теплорегуляция достигается за счет усиления испарения с поверхности тела. Кроме естественной терморегуляции большое значение имеет искусственная терморегуляция, связанная с изолированием организма от неблагоприятных условий окружающей среды. Тепловой баланс можно проверить экспериментально, определить энергию выделения организмом и энергию питательных веществ поступающих в организм. Энергия высвобождения из организма эквивалента поступающего внутрь. Т.о. все процессы жизнедеятельности соответствуют 1-му началу термодинамики.
Второе начало термодинамики в применении к биосистемам:
Второе начало термодинамики указывает на качественное различие форм энергии. Тепловая энергия образуется в организме, является определенной формой связанной энергии, т.е. в процессе жизнедеятельности она не может не может быть полностью превращена в другие виды. Для описания связанной энергии используется понятие энтропии. 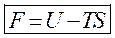
Энтропия является функцией состояния и определяется с точностью до произвольной постоянной. Для изолированных систем энтропия не убывает, т.е. при протекании внутри системы необратимых процессов, энтропия возрастает, а при обратимом не меняется. Говорят о запасе энергии в системе, наиболее важно знать какую работу она может совершить над внешними телами, либо внутри самой системы. Для этого используется свободная энергия или энергия Гиббса. Для биосистем, процессы протекают при постоянной температуре и мало изменяющейся плотности и объеме. Т.о. для нормальных условий, свободно превращается часть внутренней энергии системы одинаковое в системе как свободной энергии, так и энергии Гиббса. Т.о. для оценки возможностей работы живого организма необходимо учитывать изменения свободной энергии или потенциал Гиббса. Существуют методы расчета изменения потенциала Гиббса для химических реакций.

Однако для биологических систем закон возрастания энтропии не наблюдается, что послужило причиной сомнения возможности применения 2-го закона термодинамики для животных систем. Согласно формулировке этого закона, возрождения энтропии определяет направление большинства естественных процессов в природе. Однако, закон возрождения энтропии справедлив только в изолированной системе и не может быть применен к живому организму на основании того, что это открытая система. Для изолированной системе в состоянии равновесия энтропия максимальна, а все термодинамические потенциалы, в том и собственная энергия и энергия Гиббса оказывается минимальным. В открытой же системе в стационарном состоянии изменение энтропии может быть отрицательно, а значение F или G могут вообще не изменяться.
Для изолированных систем  :
: 
Для открытых систем: 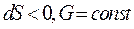
2-е начало термодинамики для открытых систем впервые было сформулировано Пригожыным.
Изменение энтропии открытых систем можно представить виде 2-х частей.

Первое слагаемое определяет изменение энтропии за счет внешних процессов. Второе слагаемое определяет изменение энтропии за счет процессов, протекающих внутри системы. 
Это связано с необратимостью процессов расщепления питательных веществ, выравниванием градиентов, что всегда сопровождается увеличением энтропии. Аналогично энтропии можно разделить потенциал Гиббса.

Внутренние процессы сопровождаются расходом и убыванием потенциала Гиббса, который за счет обмена с окружающей средой может как увеличиваться, так и уменьшаться. В общем случае знак и величина изменения энтропии в разные промежутки времени изменяются, поэтому удобно рассматривать скорость изменения энтропии в открытой системе.

Для поддержания жизнедеятельности необходимо непрерывное поступление в организм свободной энергии из окружающей среды для компенсации убыли свободной энергии за счет внутренних процессов. Уменьшение энтропии в животной системе в ходе потребления пищевых продуктов и солнечной энергии одновременно приводит к увеличению свободной энергии системы. Т.е. приток отрицательной энергии не связан с упорядочению живых структур. Деградация питательных веществ приводит к выделению свободной энергии необходимой организму. Поток отрицательной энтропии необходим для компенсации нарастания энтропии и убыли свободной энергии, которая происходит внутри клетки в результате самопроизвольных процессов жизнедеятельности. Т.о. открытая система представляет собой процесс круговорота и превращения свободной энергии. Если внутри открытой системы достигнуто равновесие в отношении температуры, то и процессы обмена с окружающей средой протекают равновесно. Устойчивым состоянием открытой системы является стационарное состояние. Термодинамические условия возникновения стационарного состояния является равенство между изменением энтропии внутри организма и потоком энтропии в окружающую среду. Т.е. для открытой системы условием стационарного состояния является: 

Постоянство энтропии не означает термодинамическое равновесие с окружающей средой. Равновесие организма с окружающей средой означает биологическую смерть. Для открытой системы постоянство энтропии устанавливает стационарное состояние системы и характеризует не отсутствие обратимых процессов, как в случае равновесия в изолированной среде, а взаимодействие с окружающей средой в наиболее оптимальной форме. Т.о. 2-е начало термодинамики для открытых систем помогает указать на целесообразность стационарного состояния системы. Впервые этот принцип был сформулирован Пригожыным в виде теоремы:
В стационарном состоянии производство энтропии внутри системы имеет постоянную и наименьшую из всех возможных скоростей.

Теорема указывает на то, что стационарное состояние обеспечивает наименьшие потери свободной энергии. В таком состоянии организм функционирует наиболее эффективно.
Дата добавления: 2015-02-09; просмотров: 363; Мы поможем в написании вашей работы!; Нарушение авторских прав |