
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Билет №7
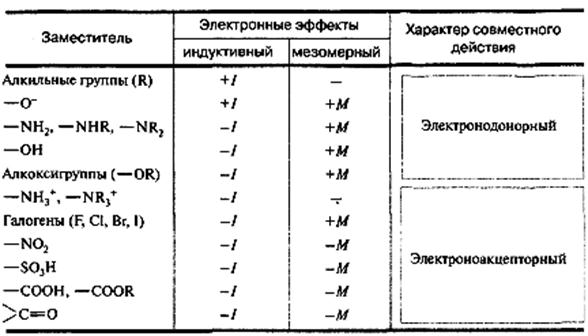
1. Поляризация связей и электронные эффекты (индуктивный и мезомерный) как причина неравномерного распределения электронной плотности и возникновения реакционных центров в молекуле. Электронодонорные и электроноакцепторные заместители.
Поляризация химической связи — асимметрия (смещение) электронной плотности, связывающей молекулярной орбитали ковалентной связи. Если атомы, образующие ковалентную связь, одинаковы и несут одинаковые или близкие по электроотрицательности заместители, распределение электронной плоскости симметрично относительно плоскости, перпендикулярной связи и пересекающей связь на равных расстояниях от атомов; такие связи называют неполярными. В случае, когда атомы, образующие ковалентную связь различны или несут различные заместители, электронная плотность смещается в сторону более электроотрицательного атома; такие связи называются поляризованными (полярная связь). Большинство ковалентных связей являются полярными. Молекулы с полярной связью обычно гораздо более реакционноспособны, чем неполярные молекулы. Полярность связи не следует отождествлять с полярностью молекул, которая зависит также от геометрического расположения атомов в молекуле.
Наличие в молекуле полярной σ-связи вызывает поляризацию ближайших σ-связей и ведёт к возникновению частичных зарядов на соседних атомах (обозначаются буквой δ с указанием знака: «+» или «-»). Таким образом, заместители вызывают поляризацию не только «своей», но и соседних σ-связей. Вид передачи электронного влияния заместителей за счёт смещения электронов σ-связей принято называть индуктивным эффектом (I-эффект). Из-за слабой поляризуемости σ-связи индуктивный эффект затухает через три-четыре связи в цепи. Направление индуктивного эффекта заместителя принято качественно оценивать путём сравнения с атомом водорода, индуктивный эффект которого принят за ноль. Графически его действие обозначают прямой стрелкой, совпадающей с положением валентной чёрточки и направленной в сторону более электроотрицательного атома. Заместители, притягивающие электронную плотность сильнее, чем атом водорода, принято называть электроноакцепторами, а их индуктивный эффект – отрицательным (-I). Такие заместители снижают электронную плотность системы. К ним относятся большинство функциональных групп и катионы. Соответственно, заместители, смещающие электронную плотность в сторону атома углерода цепи, проявляет положительный электронный эффект (+I) и являются электроноакцепторами. Такие заместители ведут к повышению электронной плотности. К их числу относятся алкильные группы, металлы и анионы.
В сопряжённых системах в передаче электронного влияния основную роль играют π-электроны делокализованных ковалентных связей. Эффект, проявляющийся в смещении электронной плотности делокализованной (сопряжённой) π-системы, называется мезомерным (М-эффект), или эффектом сопряжения. При этом заместитель сам является участником сопряжённой системы. Он может вносить в систему сопряжения π-связь, неподелённую пару электронов гетероатома, валентную или заполненную одним или двумя электронами р-атомную орбиталь. Аналогично индуктивному эффекту, заместители, повышающие электронную плотность в сопряжённой системе, проявляют +М-эффект и являются электронодонорами (им обладают заместители, содержащие атомы с неподелённой парой электроновили целым отрицательным зарядом), а понижающие электронную плотность проявляют –М эффект и являются электроноакцепторами (им обладают ненасыщенные группировки и положительно заряженные атомы). Графически смещение электронной плотности обозначается изогнутыми стрелками, начало которых показывает, какие р- или π-электроны смещаются, а конец – связь или атом, к которым они смещаются. В отличие от индуктивного, мезомерный эффект передаётся по системе сопряжённых связей на значительно большее расстояние.
В таблице ниже указаны индуктивный и мезомерный эффекты некоторых заместителей, а также их результирующее действие.
2. Пептиды. Строение пептидной группы. Гидролиз пептидов. Понятие об установлении аминокислотного состава и аминокислотной последовательности пептидов.Частичный и полный гидролиз белков. Понятие о сложных белках. Гликопротеины, липопротеины, нуклеопротеины, фосфопротеины.
Пептиды – природные или синтетические соединения, молекулы которых построены из остатков α-аминокислот, соединенных между собой пептидными (амидными) связями – C(O) – NH –. Могут содержать в молекуле также неаминокислотную компоненту (сложные белки). По числу аминокислотных остатков, входящих в молекулы пептидов, различают дипептиды, трипептиды, тетрапептиды и т.д. Пептиды, содержащие до 10 аминокислотных остатков, называются олигопептидами, содержащие более 10 аминокислотных остатков – полипептидами. Природные полипептиды с молекулярной массой более 6 тыс. а.е.м. называют белками.
В пептидной (амидной) группе – С(О) – NH – атом углерода находится в состоянии sp2-гибридизации. Неподелённая пара электронов атома азота вступает в сопряжение с π-электронами двойной связи С=О. С позиций электронного строения пептидная группа представляет собой трехцентровую p,π-сопряженную систему, электронная плотность в которой смещена в сторону более электроотрицательного атома кислорода. Атомы С, О и N, образующие сопряженную систему, находятся в одной плоскости. Распределение электронной плотности в амидной группе можно представить с помощью граничных структур (I) и (II) или смещения электронной плотности в результате +M- и – M-эффектов групп NH и C=O соответственно (III).
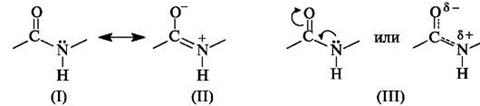
В результате сопряжения происходит некоторое выравнивание длин связей. Двойная связь С=О удлиняется до 0,124 нм против обычной длины 0,121 нм, а связь С-N становится короче – 0,132 нм по сравнению с 0,147 нм в обычном случае. Плоская сопряженная система в пептидной группе служит причиной затруднения вращения вокруг связи С-N. Таким образом, электронное строение предопределяет достаточно жёсткую структуру пептидной группы.
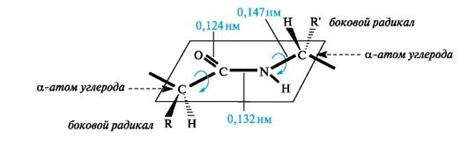
Плоскостное расположение пептидной группы -CO-NH- и α-атомов углерода аминокислотных остатков
α-атомы углерода аминокислотных остатков располагаются в плоскости пептидной группы по разные стороны от связи С-N, т.е. в более выгодном тpанс-положении: боковые радикалы R аминокислотных остатков в этом случае будут наиболее удалены друг от друга в пространстве. Полипептидная цепь имеет удивительно однотипное строение и может быть представлена в виде ряда расположенных под углом друг к другу плоскостей пептидных групп, соединенных между собой через α-атомы углерода связями Сα-N и Сα-Сsp2. Вращение вокруг этих одинарных связей весьма ограничено вследствие затруднений в пространственном размещении боковых радикалов аминокислотных остатков. Таким образом, электронное и пространственное строение пептидной группы во многом предопределяет структуру полипептидной цепи в целом.
Гидролиз пептидов может происходить в кислой или щелочной среде, а также под действием ферментов. В кислой и щелочной средах образуются соли аминокислот:
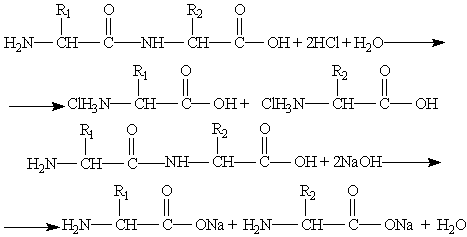
Ферментативный гидролиз важен тем, что протекает селективно,т. е. позволяет расщеплять строго определенные участки пептидной цепи.
Аминокислотный состав белков – это природа и количественное соотношение входящих в них α-аминокислот. Устанавливается путём пептидных и белковых гидролизатов в основном хроматографическими методами. В настоящее время такой анализ осуществляется с помощью аминокислотных анализаторов.
Пептиды и белки гидролизуются либо с образованием более коротких цепей (частичный гидролиз), либо смеси α-аминокислот (полный гидролиз).
Гликопротеины — это сложные белки, в которых белковая (пептидная) часть молекулы ковалентно соединена с одной или несколькими группами гетероолигосахаридов.
Липопротеины — класс сложных белков, простетическая группа (группа неаминокислотной природы) которых представлена каким-либо липидом.
Нуклеопротеины — комплексы нуклеиновых кислот с белками.
Фосфопротеины – это сложные белки, содержащие в своем составе в качестве простетической части фосфорную кислоту.
3. Ввиду наличия отсутствия информации о формулировке вопроса, администрация предлагает вам ознакомиться с предполагаемым ответом.
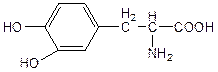
4. Ввиду наличия отсутствия информации о формулировке вопроса, администрация предлагает вам ознакомиться с предполагаемым ответом.
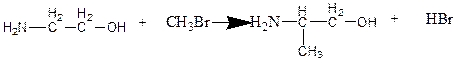
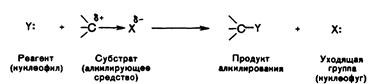
5. Ввиду наличия отсутствия информации о формулировке вопроса, администрация предлагает вам ознакомиться с предполагаемым ответом.
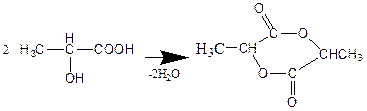
Дата добавления: 2015-02-10; просмотров: 1716; Мы поможем в написании вашей работы!; Нарушение авторских прав |