
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Билет №10
1. Реакции электрофильного присоединения. Механизм реакций гидрогалогенирования и гадратации. Кислотный катализ. Влияние статических и динамических факторов н региоселективность реакций. Особенности электрофильного присоединения к сопряжённым системам. Гидратация α, β-непредельных кислот в организме.
Ненасыщенные углеводороды – алкены и циклоалкены – содержат двойные связи и проявляют способность к реакциям присоединения по этим связям. Благодаря электронам π-связи в молекулах алкенов имеется область повышенной электронной плотности, поэтому они склонны подвергаться атаке электрофильными реагентами.
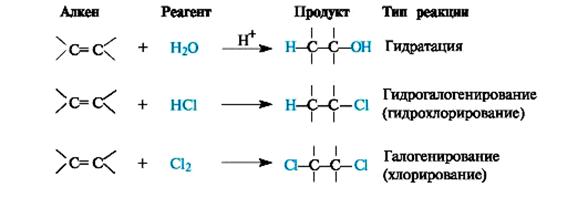
Присоединение воды к алкенам (гидратация) осуществляется только в присутствии катализатора, как правило, серной кислоты. Это известный способ получения спиртов.
Общее описание механизма реакции электрофильного присоединения (AE). Присоединение к алкенам электрофильных реагентов НХ (Н2О, ННа1 и т.п.) протекает по гетеролитическому механизму. Электрофильной частицей в данном процессе служит простейший электрофил – протон.
В реакции выделяют две основные стадии:
• атаку алкена протоном с образованием карбокатиона (медленная стадия, определяющая скорость процесса в целом);
• атаку образовавшегося карбокатиона нуклеофилом; в реакции гидратации это молекула Н2О (быстрая стадия).
При гидратации алкенов в условиях кислотного катализа за двумя этими стадиями следует третья – быстрая стадия отщепления протона (возврат катализатора).
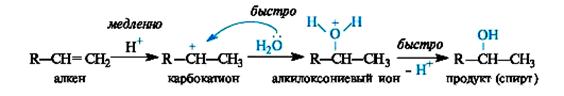
Несимметричные алкены образуют, как правило, один из возможных структурных изомеров. В случае преимущественного образования одного из нескольких возможных структурных изомеров различным положением вводимой функциональной группы говорят о высокой региоселективности реакции.
Региоселективность – предпочтительное протекание реакции по дному из нескольких реакционных центров одинаковой химической природы.
В.В. Марковников сформулировал закономерность, определяющую направление присоединения, которая вошла в мировую химию под названием правила Марковникова.
При взаимодействии реагентов типа НХ с несимметричными алкенами атом водорода присоединяется к атому углерода, связанном с максимальным числом атомов водорода, т.е. к наиболее «гидрогенизированному» атому углерода двойной связи.
Такое направление реакции объясняется совокупностью двух факторов. В статическом, т. е. нереагирующем, состоянии в несимметричных алкенах электронная плотность π-связи смещена под влиянием заместителя. Возникшие частичные заряды определяют место будущей атаки протоном. В пропене таким местом будет атом С-1 с частичным отрицательным зарядом (как следствие +I-эффекта метильной группы). Таким образом, статический фактор благоприятствует электрофильной атаке по группе СН2 (путь а), что приводит к вторичному карбокатиону (I). При атаке по атому С-2 должен был бы образоваться менее стабильный первичный карбокатион (II) (путь б).

В динамическом состоянии, т. е. в ходе реакции, из двух возможных карбокатионов (I) или (II) будет образовываться более устойчивый. Во вторичном карбокатионе положительно заряженный атом углерода связан с двумя электронодонорными алкильными группами, в первичном – с одной. В результате во вторичном карбокатионе за счет +I- эффекта двух алкильных групп осуществляется более эффективное уменьшение положительного заряда. Таким образом, качественная оценка относительной устойчивости промежуточных частиц также говорит в пользу образования вторичного карбокатиона (путь а).
В рассмотренном примере оба фактора, статический и динамический, действуют согласованно. При несогласованном действии статического и динамического факторов последний играет решающую роль. В современной интерпретации правило Марковникова, определяющее региоселективность реакций ненасыщенных соединений, формулируется следующим образом.
Направление присоединения реагентов типа НХ к несимметричным алкенам определяется относительной устойчивостью промежуточно образующихся карбокатионов.
Правило Марковникова применяется без оговорок только к алкенам. Однако ненасыщенные соединения часто содержат при двойной связи электроноакцепторные группы (карбоксильную, альдегидную и др.). Учитывая поляризацию связи С=С под влиянием заместителя (статический фактор), можно предсказать иной характер присоединения, а именно, против правила Марковникова. Например, при гидратации α,β-ненасыщенных карбоновых кислот в сильно кислой среде образуются β-гидроксикарбоновые кислоты.

Такой результат можно объяснить и сравнением стабильности промежуточно образующихся карбокатионов (динамический фактор). Катион (I) с одноименными зарядами на соседних атомах углерода менее стабилен, чем катион (II), в котором заряды разделены.

Алкены и циклоалкены в достаточно мягких условиях взаимодействуют с галогеноводородами, серной и другими сильными кислотами, способными к диссоциации с образованием протона. В результате присоединения галогеноводородов образуются галогенопроизводные алканов и циклоалканов.

Особенность сопряженных диенов состоит в том, что две двойные связи в их молекулах функционируют как единое целое, поэтому реакции присоединения могут протекать в двух направлениях: а) к одной из двойных связей (1,2-присоединение) или б) в крайние положения сопряженной системы с образованием новой двойной связи в центре системы (1,4-присоединение). Так, присоединение брома к бутадиену может привести к двум продуктам: 1,2
СН2=СН-СН=СН2 + Вr2→СН2=СН-СНВr-СН2Вr
или 1,4
СН2=СН-СН=СН2 + Вr2→ВrСН2-СН=СН-СН2Вr
Подбор реагентов и условий реакций позволяет направлять присоединение по любому из двух направлений, однако последний предпочтительнее.
В реакции с концентрированной серной кислотой алкены образую гидросульфаты, в результате гидролиза которых получаются спирты.

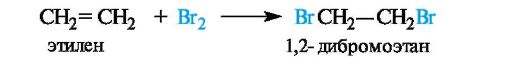
Алкены в обычных условиях легко присоединяют галогены. Так, быстрое обесцвечивание бромной воды без выделения бромоводорода служит качественной пробой на двойную связь. Еще легче проходит присоединение хлора.
Восстановление двойных связей алкенов осуществляется каталитическим гидрированием – присоединением водорода в присутствии металлов (никеля – при нагревании, платины или палладия – при обычной температуре). Результатом является образование насыщенного продукта – алкана (отсюда, кстати, и возникли термины «насыщенные» и «ненасыщенные» соединения).

Окисление двойных углерод-углеродных связей в зависимости от условий может приводить к эпоксидам, 1,2-диолам (гликолям) или карбонильным соединениям – продуктам расщепления двойной связи.
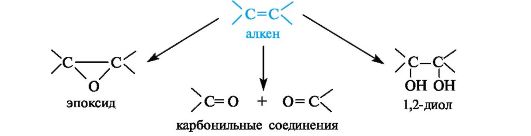
Эпоксиды образуются при обработке алкенов пероксидными соеди- нениями, например пербензойной кислотой.

1,2-диолы (гликоли) могут быть получены в результате гидролиза эпоксидов в кислой или щелочной среде.

Непосредственно из алкенов 1,2-диолы образуются под действием водного раствора перманганата калия на холоду (реакция Вагнера).
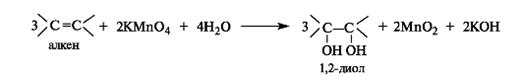
Внешние проявления реакции – исчезновение пурпурной окраски перманганата калия и образование коричневого осадка оксида марганца(IV). Эту реакцию можно использовать как качественную для обнаружения алкенов, а также для их отличия от спиртов, поскольку спирты в таких условиях не окисляются.
В более жестких условиях расщепляется углерод-углеродная связь и образуются кетоны и/или карбоновые кислоты.

В клетках в условиях in vivo важное значение имеет реакция гидратации активной формы кротоновой кислоты, участвует фермент крононаза). Реакция идет в соответствии с распределением электронной плотности в молекуле, образуется активная форма 3- гидроксибутановой кислоты.
СН3 – СН = СН – СОSКоА + Н2О ——> СН3 – СН – СН2– СОSКоА
|
ОН
По такой же схеме происходит гидратация активных форм любых 2,3 – непредельных кислот, которые образуются как в процессе синтеза., так и метаболизма высших карбоновых кислот в организме человека, животных, в клетках микроорганизмов.
R – СН 2 – СН = СН – СОSКоА + Н2О ——> R–СН2 –СН – СН 2 – СОSКоА
|
ОН
2. Взаимопревращение альдоз и кетоз. Реакции альдольного типа в ряду моносахаридов. Альдольное присоединение дигидроксиацетона к глицериновому альдегиду. Альдольное расщепление фруктозы. Образование нейраминовой кислоты.
В разбавленных растворах щелочей при комнатной температуре происходит изомеризация моносахаридов, т.е. получение из одного моносахарида равновесной смеси моносахаридов, различающихся конфигураиями атомов С-1 и С-2. Рассмотрим на примере D-глюкозы.

Альдольное присоединение дигидроксиацетона к глицериновому альдегиду и альдольное расщепление фруктозы – обратные процессы.
CH2 – CH – CH = O + CH2 – C – CH2 → CH2 – CH – CH – CH – C – CH2
| | | | | | | | | | | | |
OH OH OH O OH OH OH OH OH O OH
Нейраминовая кислота получается ферментативным путём в результате альдольной конденсации пировиноградной кислоты и D-маннозамина. Для приведения указанной ниже реакции к требуемому виду CН3CO следует заменить на Н.

3. Напишите проекционные формулы стереоизомеров 1-гидрокси-1,2,3-пропантрикарбоновой (изолимонной) кислоты. Имеется ли среди них мезоформа?
Молекула не имеет плоскости симметрии, поэтому среди её стереоизомеров отсутствует мезоформа.
COОH COОH
 |  |

 H ОН НО H
H ОН НО H

 H COOH HOOC H
H COOH HOOC H
CH2COОH CH2COОH
COОH COОH
 |  |

 HO Н Н OH
HO Н Н OH

 H COOH HOOC H
H COOH HOOC H
CH2COОH CH2COОH
4. Первой стадией синтеза эфедрина является ацилирование бензола хлорангидридом 2-хлорпропановой кислоты. Напишите схему реакции и укажите механизм.
Эта реакция протекает в присутствие AlCl3 по механизму электрофильного замещения.
 + HCl
+ HCl
5. Объясните антибактериальное действие препаратов на основе 8-гидроксихинолина.
В основе биологического действия соединений 8-гидроксихинолинового ряда лежит их способность к образованию прочных хелатных комплексов с ионами некоторых металлов. Таким образом, происходит «связывание» элементов, необходимых для жизнедеятельности бактерий.

Дата добавления: 2015-02-10; просмотров: 2450; Мы поможем в написании вашей работы!; Нарушение авторских прав |