
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Билет №12
1. Реакции нуклеофильного замещения у sp3 – гибридизированного атома углерода. Гетеролитические реакции, обусловленные поляризацией σ-связи углерод-гетероатом (галогенопроизводные, спирты). Реакции гидролиза галогенпроизводных. Реакции алкилирования спиртов, фенолов, тиолов, сульфидов, аммиака и аминов. Дезаминирование соединений с первичной аминогруппой. Биологическая роль реакций алкилирования.
В галогенпроизводных, спиртах, тиолах и аминах алифатического ряда тетрагональный sp3-гибридизованный атом углерода связан одинарной σ-связью с гетероатомом функциональной группы. Гетероатом более электроотрицателен, чем углерод, и электроны σ-связи смещены в его сторону. Поэтому данные соединения являются субстратами в реакциях нуклеофильного замещения SN. Y- + Cδ+à(Xδ-) à C – Y + X-
Нуклеофильное замещение может протекать по двум основным механизмам – бимолекулярному и мономолекулярному. При бимолекулярном механизме атакующая частица постепенно вытесняет уходящую группу. Образование новой и разрыв старой связи происходит одновременно (синхронно). При мономолекулярном механизме сначала происходит медленная ионизация связи углерод-гетероатом в субстрате, а затем быстрая атака реагентом по атому углерода в образовавшейся положительно заряженной частице. С другой стороны спирты, тиолы и амины в реакциях нуклеофильного замещения могут быть и нуклеофильными реагентами либо за счет свободной электронной пары гетероатома, либо в результате образования анионов за счет разрыва связи гетероатом-водород. Склонность соединений тип R – X, в которых атом углерода связан с более электроотрицательным гетероатомом (галогеном, кислородом, серой или азотом) к нуклеофильному замещению определяется полярностью связи C – X (статический фактор) и способностью заместителя X к замещению (динамический фактор). Величина полярности С – X связи зависит от электроотрицательности гетероатома Х, поэтому полярность С-X связи увеличивается при переходе от азотсодержащих соединений к соответсвующим кислород- и фторпроизводным.
Способность заместителя Х к отщеплению определяется величиной энергии связи С-Х и характером уходящей группы. Так, с увеличением объема галогена связь углерод-галоген становится менее прочной и легкость ее разрыва растет в ряду С-F<C-Cl<C-Br<C-I. Важно, чтобы замещаемая, иначе говоря, уходящая группа была более стабильной, более бедной энергнией по сравнению с атакующим нуклеофилом, т.е. входящей группой. К хорошо уходящим группам относятся галогенид-ионы. В отличие от галогенид-ионов сильные основания, такие как HO-, RO-, NH2-, CH-3, H-, являются плохоуходящими группами. Поэтому наблюдается следующий ряд реакционно способности субстратов в реакциях нуклеофильного замещения: галогенпроизводные RHal > спирты ROH > амины RNH2. Реакции гидролиза галогенопроизводных. Мономолекулярное нуклеофильное замещение SN1 не является синхронным и состоит из двух основных стадий. В первой стадии, определяющей скорость процесса в целом, участвует только молекула субстрата, которая относительно медленно диссоциирует (под воздействием среды) с образованием карбокатиона и уходящей группы. Поэтому скорость реакции не зависит от концентрации нуклеофила. Последний в следующей стадии быстро атакует карбокатион, образуя конечный продукт реакции. Примером может служить гидролиз трет-бутилхлорида избытком воды. (CH3)3CCl + H2O à (CH3)3COH + HCl; (CH3)C-Cl à CH3C+ + H2O à (CH3)3C-O+H à (CH)3C-OH
Примером реакции SN1 является гидролиз трет-бутилбромида (вторая реакция ниже), а реакции SN2 – гидролиз этилбромида (первая реакция ниже).


В условиях организма важной стадией наращивания углеродной цепи в биосинтезе терпенов и стероидов является алкилирование 3-метилбутен-3-фосфата, приводящее к предшественнику монотерпенов – геранилдифосфату.
Алкилирование ароматических субстратов имеет место быть при биосинтезе некоторых коферментов и жирорастворимых витаминов.
Группы NH2, NHR, NR2 представляют собой чрезвычайно плохие уходящие группы. Их замещение даже после превращения в ониевые ионы осуществить не удается. Однако нуклеофильное замещение группы NH2, например на группу ОН, в первичных аминах можно осуществить путем их взаимодействия с азотистой кислотой. Такая реакция называется дезаминированием.

2. Полисахариды. Крахмал (амилоза и амилопектин), гликоген, декстран, целлюлоза, полигалактуроновая кислота, хондроитинсульфаты. Представление о строении гепарина. Понятие о смешанных биополимерах (пептидогликаны, протеогликаны, гликопротеины, гликолипиды).
Полисахариды составляют основную массу органической материи в биосфере Земли. Они выполняют три важные биологические функции, выступая в роли структурных компонентов клеток и тканей, энергетического резерва и защитных веществ. Полисахариды (гликаны) – высокомолекулярные углеводы. По химической природе они являются полигликозидами (полиацеталями). По принципу строения полисахариды не отличаются от восстанавливающих олигосахаридов. Каждое звено моносахарида связано гликозидными связями с предыдущим и последующим звеньями. При этом для связи с последующим звеном предоставляется полуацетальная гидроксильная группа, а с предыдущим – спиртовая группа. Различие заключается лишь в количестве моносахаридных остатков: полисахариды могут содержать их сотни и даже тысячи.
В полисахаридах растительного происхождения наиболее часто встречаются (1-4)-гликозидные связи, а в полисахаридах животного и бактериального происхождения имеются связи и других типов. На одном конце полимерной цепи находится остаток восстанавливающего моносахарида. Поскольку его доля во всей макромолекуле очень мала, полисахариды практически не проявляют восстановительных свойств.
Гликозидная природа полисахаридов обусловливает их гидролиз в кислой и устойчивость в щелочной средах. Полный гидролиз приводит к образованию моносахаридов или их производных, неполный – к ряду промежуточных олигосахаридов, в том числе и дисахаридов.
Полисахариды имеют большую молекулярную массу. Им присущ типичный для высокомолекулярных веществ более высокий уровень структурной организации макромолекул. Наряду с первичной структурой, т.е. с определенной последовательностью мономерных остатков, важную роль играет вторичная структура, определяемая пространственным расположением макромолекулярной цепи.
Полисахаридные цепи могут быть разветвленными или неразветвленными (линейными).
Полисахариды делят на группы:
• гомополисахаридов, состоящих из остатков одного моносахарида;
• гетерополисахаридов, состоящих из остатков разных моносахаридов.
К гомополисахаридам относятся многие полисахариды растительного (крахмал, целлюлоза, пектиновые вещества), животного (гликоген, хитин) и бактериального (декстраны) происхождения.
Гетерополисахариды, к числу которых относятся многие животные и бактериальные полисахариды, изучены меньше, но играют важную биологическую роль. Гетерополисахариды в организме связаны с белками и образуют сложные надмолекулярные комплексы.
Крахмал. Этот полисахарид состоит из полимеров двух типов, построенных из D-глюкопиранозы: амилозы (10-20%) и амилопектина (80-90%). Крахмал образуется в растениях в процессе фотосинтеза и «запасается» в клубнях, корнях, семенах.
Крахмал – белое аморфное вещество. В холодной воде нерастворим, в горячей набухает и некоторая часть его постепенно растворяется. При быстром нагревании крахмала из-за содержащейся в нем влаги (10-20%) происходит гидролитическое расщепление макромолекулярной цепи на более мелкие осколки и образуется смесь полисахаридов, называемых декстринами. Декстрины лучше растворяются в воде, чем крахмал.

Амилоза – полисахарид, в котором остатки D-глюкопиранозы связаны α(1-4)-гликозидными связями, т. е. дисахаридным фрагментом амилозы является мальтоза.

Цепь амилозы неразветвленная, включает до тысячи глюкозных остатков, молекулярная масса до 160 тыс.
По данным рентгеноструктурного анализа, макромолекула амилозы свернута в спираль. На каждый виток спирали приходится шесть моносахаридных звеньев. Во внутренний канал спирали могут входить соответствующие по размеру молекулы, например молекулы иода, образуя комплексы, называемыесоединениями включения. Комплекс амилозы с иодом имеет синий цвет. Это используется в аналитических целях для открытия как крахмала, так и иода (иодкрахмальная проба).

Амилопектин в отличие от амилозы имеет разветвленное строение. Его молекулярная масса достигает 1-6 млн.

Амилопектин – разветвленный полисахарид, в цепях которого остатки D-глюкопиранозы связаны α(1-4)-гликозидными связями, а в точках разветвления – α(1-6)-связями. Между точками разветвления располагаются 20-25 глюкозных остатков.

Гидролиз крахмала в желудочно-кишечном тракте происходит под действием ферментов, расщепляющих α(1-4)- и α(1-6)-гликозидные связи. Конечными продуктами гидролиза являются глюкоза и мальтоза.
Гликоген. В животных организмах этот полисахарид является структурным и функциональным аналогом растительного крахмала. По строению он подобен амилопектину, но имеет еще большее разветвление цепей. Обычно между точками разветвления содержатся 10-12, иногда даже 6 глюкозных звеньев. Условно можно сказать, что разветвленность макромолекулы гликогена вдвое больше, чем амилопектина. Сильное разветвление способствует выполнению гликогеном энергетической функции, так как только при множестве концевых остатков можно обеспечить быстрое отщепление нужного количества молекул глюкозы.
Молекулярная масса гликогена необычайно велика и достигает 100 млн. Такой размер макромолекул содействует выполнению функции резервного углевода. Так, макромолекула гликогена из-за большого размера не проходит через мембрану и остается внутри клетки, пока не возникнет потребность в энергии.
Гидролиз гликогена в кислой среде протекает очень легко с количественным выходом глюкозы. Это используют в анализе тканей на содержание гликогена по количеству образовавшейся глюкозы.
Аналогично гликогену в животных организмах такую же роль резервного полисахарида в растениях выполняет амилопектин, имеющий менее разветвленное строение. Это связано с тем, что в растениях значительно медленнее протекают метаболические процессы и не требуется быстрого притока энергии, как иногда необходимо животному организму (стрессовые ситуации, физическое или умственное напряжение).
Декстран (С6Н10О5)n – бактериальный полисахарид, состоящий из остатков α-D-глюкопиранозы. Молекула декстрана – разветвленная цепь, линейная часть которой содержит главным образом (1-6)-связи.

Декстран получают при культивировании на искусственной питательной среде микроорганизма рода Leuconostoc. В виде частично гидролизованного раствора с молярной массой около 60 тыс. и количеством (1-6)-связей не менее 90% декстран применяется в клинике как заменитель плазмы крови.
Целлюлоза. Этот полисахарид, называемый также клетчаткой, является наиболее распространенным растительным полисахаридом. Целлюлоза обладает большой механической прочностью и выполняет функцию опорного материала растений. Древесина содержит 50-70% целлюлозы; хлопок представляет собой почти чистую целлюлозу. Целлюлоза является важным сырьем для ряда отраслей промышленности (целлюлозно-бумажной, текстильной и т. п.).
Целлюлоза – линейный полисахарид, в котором остатки D-глюко- пиранозы связаны p(1-4)-гликозидными связями. Дисахаридный фрагмент целлюлозы представляет собой целлобиозу.
Макромолекулярная цепь не имеет разветвлений, в ней содержится 2,5-12 тыс. глюкозных остатков, что соответствует молекулярной массе от 400 тыс. до 1-2 млн.

β-конфигурация аномерного атома углерода приводит к тому, что макромолекула целлюллозы имеет строго линейное строение. Этому способствует образование водородных связей внутри цепи, а также между соседними цепями.

Такая упаковка цепей обеспечивает высокую механическую прочность, волокнистость, нерастворимость в воде и химическую инертность, что делает целлюлозу прекрасным материалом для построения клеточных стенок растений. Целлюлоза не расщепляется обычными ферментами желудочно-кишечного тракта, но необходима для нормального питания как балластное вещество. Большое практическое значение имеют эфирные производные целлюлозы: ацетаты (искусственный шелк), нитраты (взрывчатые вещества, коллоксилин) и другие (вискозное волокно, целлофан).
Хондроитинсульфаты относятся к полисахаридам соединительной ткани (а именно кожа, хрящи, сухожилия).Они состоят из дисахаридных остатков N-ацетилированного хондрозина, соединенных β(1-4)-гликозидными связями.
N-Ацетилхондрозин построен из остатков D-глюкуроновой кислоты и N-ацетил-D-галактозамина, связанных β(1-3)-гликозидной связью.

Как свидетельствует название, эти полисахариды являются эфирами серной кислоты (сульфатами). Сульфатная группа образует эфирную связь с гидроксильной группой N-ацетил-D-галактозамина, находящейся в положении 4 или 6. Соответственно различают хондроитин-4-сульфат и хондроитин-6-сульфат. Молекулярная масса хондроитинсульфатов составляет 10-60 тыс.

Гепарин(полисахарид печени).В гепарине в состав повторяющихся дисахаридных единиц входят остатки D-глюкозамина и одной из уроновых кислот – D-глюкуроновой или L-идуроновой. В количественном отношении преобладает L-идуроновая кислота. Внутри дисахаридного фрагмента осуществляется α(1-4)-гликозидная связь, а между дисахаридными фрагментами – α(1-4)-связь, если фрагмент оканчивается L-идуроновой кислотой, и β(1-4)-связь, если D-глюкуроновой кислотой.
Аминогруппа у большинства остатков глюкозамина сульфатирована, а у некоторых из них ацетилирована. Кроме того, сульфатные группы содержатся у ряда остатков L-идуроновой кислоты (в положении 2), а также глюкозамина (в положении 6). Остатки D-глюкуроновой кислоты не сульфатированы. В среднем на один дисахаридный фрагмент приходятся 2,5-3 сульфатные группы. Молекулярная масса гепарина равна 16-20 тыс.

Гепарин препятствует свертыванию крови, т. е. проявляет антикоагулянтные свойства.
Полигалактуроновая, или пектовая, кислота представляет собой полимерную цепь, состоящую из соединенных связями α(1,4')-остатков D-галактуроновой кислоты, карбоксильные группы которой в той или иной степени этерифицированы метиловым спиртом; часть атомов водорода карбоксильных групп бывает замещена одинаковыми или разными катионами (в частности, катионами многовалентных металлов). Содержится в растительных соках, плодах.
Тип природных высокомолекулярных соединений, включающих ковалентно связанные фрагменты полимеров более чем одного класса, называют смешанными биополимерами. К ним относятся: пептидогликаны, протеогликаны, гликопротеины, гликолипиды.
Пептидогликаны (муреины, мукопептиды) – смешанные углевод-белковые полимеры, компоненты клеточной стенки бактерий. Углеводные цепи пептидогликанов построены из регулярно чередующихся остатков N-ацетил-D-глюкозамина и его 3-О-(R)-1-карбоксиэтилового эфира (мурамовой кислоты). Мурамовая к-та связана пептидной связью с тетра- или пентапептидами, которые образуют поперечные сшивки между отдельными углеводными цепями. Гигантские сетчатые молекулы пептидогликаны образуют жесткий чехол вокруг бактериальной клетки, который поддерживает ее форму и защищает клетку от разрушения при механических и осмотических воздействиях. К пептидогликанам ковалентными связями присоединяются другие компоненты клеточной стенки – тейхоевые кислоты и тейхуроновые кислоты, липопротеины.
Протеогликаны — сложные белки. Высокомолекулярные соединения, состоящие из белка (на белковую часть приходится 5-10% от общей массы) с высокой степенью гликозилирования (на углеводную часть приходится 90-95% от общей массы), углеводные остатки которых представляют собой длинные неразветвленные полисахаридные цепи — гликозаминогликаны, образованные чередующимися остатками гексозамина и уроновой кислоты (глюкуроновой, идуроновой или галактуроновой) либо галактозы.
Гликопротеины — это сложные белки, в которых белковая (пептидная) часть молекулы ковалентно соединена с одной или несколькими группами гетероолигосахаридов.
Как можно судить по названию, гликолипиды включают углеводные остатки (чаще D-галактозы, реже D-глюкозы) и не содержат остатка фосфорной кислоты.
3. Образование каких продуктов возможно при нагревании глутаминовой кислоты?
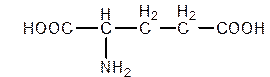

HOOC – CH – CH2 – CH2 – COOH → HOOC – CH – CH2 – CH2 + H2O
| | |
NH2 NH ––––––– C = O
2HOOC – CH – CH2 – CH2 – COOH → HOOC – CH – CH2 – CH2 – C = O
| | |
NH2 NH NH+2H2O
| |
O = C – CH2 – CH2 – CHCOOH
4. Приведите проекционные формулы конфигурационных стереоизомеров α-ацето-α-гидроксипропионовой кислоты.
COОH COОH
 |  | ||

 H3C ОН НО CH3
H3C ОН НО CH3
C(O)CH3 C(O)CH3
5. На примере подходящего соединения – 2,2-диметилбутаналя или 2-метилбутаналя – объясните альдольную конденсацию.
CH3 CH3
| |
CH3 – CH2 – CH – COH + OH- → CH3 – CH2 – C- – COH + H2O
2-метилбутаналь
CH3 CH3 CH3 O- CH3
| | | | |
CH2 – CH – COH + C- – COH → CH2 – CH – CH – C – COH → (+H2O,-OH-)
| | | |
CH3 CH2 – CH3 CH3 CH2 – CH3
CH3 OH CH3
| | |
(+H2O,-OH-) → CH2 – CH – CH – C – COH
| |
CH3 CH2 – CH3
Дата добавления: 2015-02-10; просмотров: 1355; Мы поможем в написании вашей работы!; Нарушение авторских прав |