
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Билет №16
1. Реакции окисления и восстановления органических соединений. Реакции окисления спиртов, тиолов, карбонильных соединений, аминов. Окисление π-связи и ароматических фрагментов (эпоксидирование, гидроксилирование). Реакции восстановления каронильных соединений, дисульфидов, иминов. Понятие о переносе гидрид-иона и действие системы НАД+ - НАД Н. Понятие об электронном переносе и действии системы ФАД – ФАД Н2.
Спирты (первичные и вторичные) по сравнению с углеводородами окисляются в значительно более мягких условиях. Альдегид, образующийся при этом из первичного спирта, легко окисляется далее в карбоновую кислоту.

Особым случаем окисления является дегидрирование, когда субстрат теряет два атома водорода, что эквивалентно потере двух протонов и двух электронов (2Н+ и 2е-) или протона и гидрид-иона (Н и Н ).
Тиолы при окислении образуют ряд продуктов последовательного окисления – сульфеновые, сульфиновые и сульфоновые кислоты. В этом состоит их отличие от спиртов, у которых окислению подвергается атом углерода.

Использование мягких окислителей (пероксид водорода, кислород воздуха) приводит к образованию дисульфидов. Реакция окисления тиолов и обратный ей процесс восстановления имеют важное значение в биологических системах.
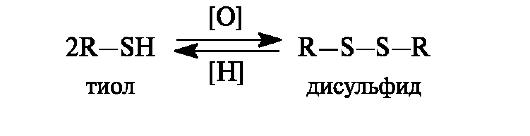
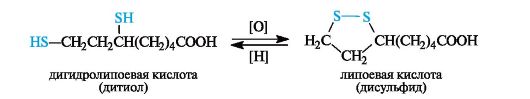
Примером дисульфида, участвующего в биохимическом окислении, может служить липоевая кислота, имеющая в составе пятичленное кольцо с дисульфидной группировкой. Восстановленная форма – дигиролипоевая кислота – представляет собой дитиол.
Сульфиды, как и тиолы, окисляются достаточно легко. Первичными продуктами окисления являются сульфоксиды, которые далее могут быть окислены в сульфоны.

Амины легко окисляются; конечными продуктами при окислении первичных аминов RNH2 являются нитросоединения RNO2. На промежуточных стадиях образуются замещенный гидроксиламин RNHOH и нитрозосоединение RN=O.

Окисление альдегидов в карбоновые кислоты осуществляется под действием большинства окислителей, включая кислород воздуха. Кетоны в мягких условиях не окисляются.

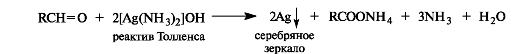
Оксид серебра в виде аммиачного комплекса [Ag(NH3)2]OH (реактив Толленса) окисляет альдегиды в карбоновые кислоты, при этом выделяется металлическое серебро. Отсюда происходит название – реакция «серебряного зеркала».
Так же легко альдегиды окисляются гидроксидом меди (II) в щелочной среде.

Обе эти реакции часто используют как качественные для обнаружения альдегидной группы, хотя они неспецифичны по отношению к альдегидам: окислению указанными реагентами подвергаются, например, многоатомные фенолы, аминофенолы, ароматические амины, гидроксикетоны и другие легкоокисляющиеся соединения.
Окисление двойных углерод-углеродных связей в зависимости от условий может приводить к эпоксидам, 1,2-диолам (гликолям) или карбонильным соединениям – продуктам расщепления двойной связи.
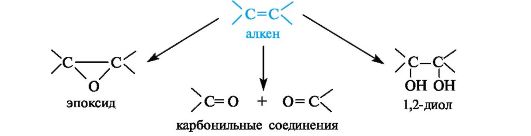
Эпоксиды образуются при обработке алкенов пероксидными соединениями, например пербензойной кислотой.

1,2-диолы (гликоли) могут быть получены в результате гидролиза эпоксидов в кислой или щелочной среде.

Непосредственно из алкенов 1,2-диолы образуются под действием водного раствора перманганата калия на холоду (реакция Вагнера).

Внешние проявления реакции - исчезновение пурпурной окраски перманганата калия и образование коричневого осадка оксида марганца (IV). Эту реакцию можно использовать как качественную для обнаружения алкенов, а также для их отличия от спиртов, поскольку спирты в таких условиях не окисляются.
В более жестких условиях расщепляется углерод-углеродная связь и образуются кетоны и/или карбоновые кислоты.

Ароматическим углеводородам бензольного ряда (аренов) свойственны реакции, не приводящие к нарушению ароматической системы, т.е. реакции замещения. Арены не склонны вступать в реакции присоединения или окисления, ведущие к нарушению ароматичности.
По этой причине при окислении гомологов бензола и других ароматических соединений в жестких условиях (нагревание с перманганатом калия или дихроматом калия в кислой среде) окисляются только боковые углеводородные радикалы. Отметим, что более низкая токсичность толуола по сравнению с бензолом объясняется именно легкостью его окисления in vivo в бензойную кислоту.

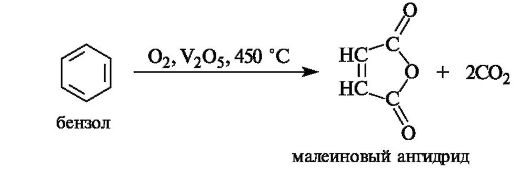
Окисление непосредственно бензольного цикла с его раскрытием и получением малеинового ангидрида осуществляется в чрезвычайно жестких условиях (достаточно обратить внимание на температуру).
Восстановлениеальдегидов и кетонов осуществляют с помощью комплексных гидридов металлов LiAlH4, NaBH4. Реакция включает нуклеофильную атаку карбонильного атома углерода гидрид-ионом. При последующем гидролизе образовавшегося алкоголята получается первичный или вторичный спирт.

Дисульфиды легко восстанавливаются в тиолы. Процесс окисления тиолов и восстановления дисульфидов играет важную роль в химии белков и пептидов:

Тиолом является одна из важных серосодержащих аминокислот – цистеин, входящая в состав белков и образующая при мягком окислении свой дисульфидный аналог – цистин. В белковой молекуле дисульфидные связи играют роль своебразных «застежек»-мостиков, скрепляющих отдельные фрагменты полипептидной цепи, вследствие чего возникает определенная конфигурация цепи, необходимая для выполнения белком своих функций.
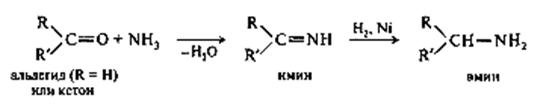
Имины являются промежуточными продуктами в общем способе получения аминов из альдегидов и кетонов путём восстановительного аминирования. Этот способ заключается в восстановлении смеси карбонильного соединения с аммиаком (или амином). Процесс протекает по схеме присоединения-отщепления с образованием имина, который затем восстанавливается в амин. Восстановительное аминирование осуществляется в организме в ходе синтеза α-аминокислот.
Одним из участников окислительно-восстановительных процессов в организме является кофермент НАД+ (окисленный никотинамиддинуклеотид), оксисленная форма которого служит акцептором гидрид-иона при биологическом дегидрировании, превращаясь при этом в восстановленную форму НАДН (восстановленный никотинамиддинуклеотид).

Например, с участием НАД+ осуществляется одна из наиболее универсалных реакций биологического окисления – дегидрирование спирта в альдегид или кетон.

Другой возможный участник процессов дегидрирования in vivo – кофермент ФАД (флавинадениндинуклеотид), являющийся акцептором двух атомов водорода и превращающийся в восстановленную форму ФАДН2.
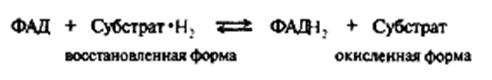
Примером реакции с участием ФАД может служить α,β-дегидрирование насыщенных жирных кислот (в виде производных кофермента А).
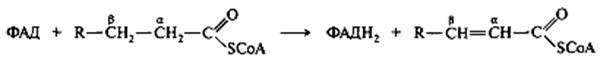
2. Нуклеозидмоно- и полифосфаты. АМФ, АДФ, АТФ. Нуклеотиды. Никотинамиднуклеотидные коферментыю Строение НАД+ и его фосфата НАДФ+. Система НАД+ - НАД Н.
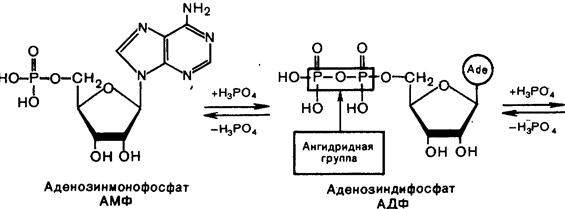
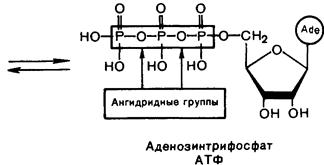
Во всех тканях организма в свободном состоянии содержатся моно-, ди- и трифосфаты нуклеозидов. Особенно известны аденинсодержащие нуклеотиды – аденозин-5'-монофосфат (АМФ), аденозин-5'-дифосфат (АДФ) и аденозин-5'-трифосфат (АТФ). В ряде биохимических реакций участвуют такие нуклеотиды, как гуанозинтрифосфат (GTP), уридинтрифосфат (UTP), цитидинтрифосфат (CTP). Их дифосфатные формы обозначаются соответственно GDP, UDP, CDP.
Нуклеотиды, фосфорилированные в разной степени, способны к взаимопревращениям путём наращивания или отщепления фосфатных групп. Дифосфатная группа содержит одну, а трифосфатная – две ангидридные связи, называемые макроэргическими, поскольку они обладают большим запасом энергии. Необходимые для образования такой связи энергетические затраты покрываются за счёт энергии, выделяющейся в процессе метаболизма углеводов. При расщеплении макроэргической связи Р~О (обозначается волнистой линией) выделяется ~ 32 кДж/моль. С этим связана важнейшая роль АТФ как «поставщика» энергии во всех живых клетках.


ГТФ УТФ

ЦТФ
Наиболее важными представителями группы никотинамиднуклеотидов являются никотинамидадениндинуклеотид(NAD, или в русской литературе НАД) и его фосфат (NADP, или НАДФ). Эти соединения выполняют важную роль коферментов в осуществлении многих окислительно-восстановительных реакций. В соответствии с этим они могут существовать как в окисленной (НАД+, НАДФ+), так и восстановленной (НАДН, НАДФН) форме.

Структурным фрагментом НАД+ и НАДФ+ является никотинамидный остаток в виде пиридиниевого катиона. В составе НАДН и НАДФН этот фрагмент превращается в остаток 1,4-дигидропиридина.
В ходе биологического дегидрирования субстрат теряет два атома водорода, т. е. два протона и два электрона (2Н+, 2е) или протон и гидрид-ион (Н+ и Н-). Кофермент НАД+ обычно рассматривается как акцептор гидрид-иона Н- (хотя окончательно не установлено, происходит ли перенос атома водорода к этому коферменту одновременно с переносом электрона или эти процессы протекают раздельно).

В результате восстановления путем присоединения гидрид-иона к НАД+ пиридиниевое кольцо переходит в 1,4-дигидропиридиновый фрагмент. Этот процесс обратим.

В реакции окисления ароматический пиридиниевый цикл переходит в неароматический 1,4-дигидропиридиновый цикл. В связи с потерей ароматичности возрастает энергия НАДН по сравнению с НАД+. Таким способом НАДН запасает энергию, которая затем расходуется в других биохимических процессах, требующих энергетических затрат.
Типичными примерами биохимических реакций с участием НАД+ служат окисление спиртовых групп в альдегидные (например, превращение ретинола в ретиналь), а с участием НАДН - восстановление карбонильных групп в спиртовые (превращение пировиноградной кислоты в молочную).
3. Приведите проекционную формулу стереоизомера природной кислой α-аминокислоты. Назовите её по заместительной номенклатуре ИЮПАК.
Аспарагиновая кислота: HOOC – CH2 – CH – COOH
|
NH2
COOH COОH
 |  |

 H2N Н Н NH2
H2N Н Н NH2
CH2CОOH CH2CОOH
L-2-аминобутандиовая кислота D-2-аминобутандиовая кислота
(природная форма)
4. Образование каких соединений возможно при нагревании этанольного раствора D-галактозы в присутствии HCl? Приведите уравнения реакций.

 + С2Н5ОН →(HCl)→
+ С2Н5ОН →(HCl)→
. C2H5 +H2O

+ C2H5OH → CH2–(CHOH)4 – CHOH
| |
OH OC2H5
полуацеталь
→(HCl)→ CH2–(CHOH)4 – CHOС2Н5
| |
OH OC2H5
Ацеталь
5. Для фенилаланина напишите катионную форму.

– СH2 – CH – COOH
|
NH3+
Дата добавления: 2015-02-10; просмотров: 3689; Мы поможем в написании вашей работы!; Нарушение авторских прав |