
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Билет №18
1. Двухосновные карбоновые кислоты (щавелевая, малоновая, янтарная, глутаровая, фумаровая). Превращение янтарной кислоты в фурмановую как пример биологической реакции дегидрирования.
Карбоновые кислоты, содержащие в своем составе одну карбоксильную группу, называют одноосновными, две – двухосновными и т.д. Далее мы рассмотрим некоторые двухосновные карбоновые кислоты, все они являются кристаллическими веществами.
| Название кислоты | Формула | Название аниона или основы сложного эфира |
| Щавелевая (этандиовая) Малоновая (пропандиовая) Янтарная (бутандиовая) Глутаровая (пентандиовая) | НООС-СООН НООССН2СООН НООС(СН2)2СООН НООС(СН2)3СООН | Оксалат Малонат Сукцинат Глутарат |
Систематические названия дикарбоновых кислот строятся по общим правилам заместительной номенклатуры. Однако для большинства из них предпочтительны тривиальные названия. Их латинские названия служат основой названия анионов и производных кислот, которые часто не совпадают с русскими тривиальными названиями.
Щавелевая кислота – простейшая двухосновная кислота. Некоторые ее соли, например оксалат кальция, трудно растворимы и часто образуют камни в почках и мочевом пузыре (оксалатные камни).
Янтарная кислота в заметном количестве была обнаружена в янтаре, откуда получила название сама кислота и ее производные сукцинаты (от лат. succinium - янтарь).
Малеиновая и фумаровая кислоты – представители ненасыщенных дикарбоновых кислот с одной двойной связью. Фумаровая кислота участвует в обменных процессах, протекающих в организме.

Дикарбоновые кислоты образуют два ряда функциональных производных – по одной и по двум карбоксильным группам.
С накоплением кислотных групп увеличиваются кислотные свойства соединений. Кислотность дикарбоновых кислот больше, чем монокарбоновых. Так, щавелевая кислота (pKa 1,23) значительно сильнее уксусной (pKa 4,76), что связано с -I-эффектом группы СООН, и благодаря этому более полной делокализации отрицательного заряда в сопряженном основании.
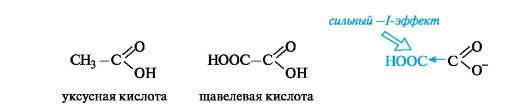
Влияние заместителя наиболее отчетливо проявляется при его близком расположении к кислотному центру.
При нагревании с серной кислотой щавелевая кислота декарбоксилируется, а образовавшаяся муравьиная кислота разлагается далее.

Малоновая кислота легко декарбоксилируется при нагревании выше 100 ºС.

В дикарбоновых кислотах, содержащих четыре или пять атомов углерода в цепи и способных вследствие этого находиться в клешневидной конформации, происходит сближение в пространстве функциональных групп. В результате внутримолекулярной атаки одной карбоксильной группой (нук- леофилом) электрофильного центра другой карбоксильной группы происходит образование (при нагревании) устойчивого пятиили соответственно шестичленного циклического ангидрида, как показано на примерах янтарной и глутаровой кислот. Другими словами, ангидриды дикарбоновых кислот являются продуктами внутримолекулярной циклизации.

Малеиновая и фумаровая кислоты проявляют сходные химические свойства: вступают в реакции, свойственные соединениям с двойной связью (обесцвечивание бромной воды, водного раствора перманганата калия) и соединениям с карбоксильными группами (образуют два ряда производных – кислые и средние соли, эфиры и т. п.). Однако только одна из кислот, а именно малеиновая, в относительно мягких условиях претерпевает внутримолекулярную циклизацию с образованием циклического ангидрида. В фумаровой кислоте вследствие удаленности карбоксильных групп друг от друга в пространстве образование циклического ангидрида невозможно.

Дегидрирование (окисление) янтарной кислоты в фумаровую, катализируемое в организме ферментом, осуществляется с участием кофермента ФАД. Реакция протекает стереоспецифично с образованием фумаровой кислоты (в ионной форме – фумарат).

2. Фосфолипиды. Фосфатидовые (фосфатидные) кислоты. Фосфатидилколамины и фосфатидилсерины (кефалины), фосфатидилхолины (лецитины) – структурные компоненты клеточных мембран.
Согласно общей классификации липидов сложные липиды обычно делят на три большие группы: фосфолипиды, сфинголипиды и гликолипиды.
В группу фосфолипидов входят вещества, отщепляющие при гидролизе фосфорную кислоту, например глицерофосфолипиды и некоторые сфинголипиды. В целом фосфолипидам свойственно достаточно высокое содержание ненасыщенных кислот.

Глицерофосфолипиды являются главными липидными компонентами клеточных мембран. По химическому строению глицерофосфолипиды представляют собой производные L-глицеро-З-фосфата.
L-Глицеро-З-фосфат содержит асимметрический атом углерода и, следовательно, может существовать в виде двух стереоизомеров.
Природные глицерофосфолипиды имеют одинаковую конфигурацию, являясь производными L-глицеро-З-фосфата, образующегося в процессе метаболизма из фосфата дигидроксиацетона.

Среди глицерофосфолипидов наиболее распространены фосфатиды – сложноэфирные производные L-фосфатидовых кислот.
Фосфатидовые кислоты – это производные L-глицеро-З-фосфата, этерифицированные жирными кислотами по спиртовым гидроксильным группам.

Как правило, в природных фосфатидах в положении 1 глицериновой цепи находится остаток насыщенной, в положении 2 – ненасыщенной кислоты, а один из гидроксилов фосфорной кислоты этерифицирован многоатомным спиртом или аминоспиртом (X – остаток этого спирта). В организме (рН ~7,4) оставшийся свободным гидроксил фосфорной кислоты и другие ионогенные группировки в фосфатидах ионизированы.
Примерами фосфатидов могут служить соединения, в составе которых фосфатидовые кислотыэтерифицированы по фосфатному гидроксилу соответствующими спиртами:
• фосфатидилсерины, этерифицирующий агент – серин;
• фосфатидилэтаноламины, этерифицирующий агент – 2-аминоэтанол (в биохимической литературе часто, но не вполне правильно называемый этаноламином);
• фосфатидилхолины, этерифицирующий агент – холин.
Эти этерифицирующие агенты взаимосвязаны между собой, поскольку фрагменты этаноламина и холина могут образовываться в ходе метаболизма из фрагмента серина путем декарбоксилирования и последующего метилирования при помощи S-аденозилметионина (SAM).
Особенностью сложных липидов является их бифильность, обусловленная неполярными гидрофобными и высокополярными ионизированными гидрофильными группировками. В фосфатидилхолинах, например, углеводородные радикалы жирных кислот образуют два неполярных «хвоста», а карбоксильная, фосфатная и холиновая группы – полярную часть.
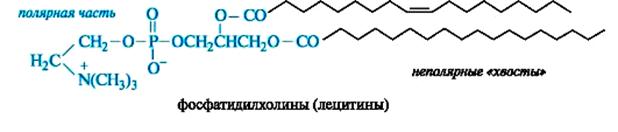
На границе раздела фаз такие соединения действуют, как превосходные эмульгаторы. В составе клеточных мембран липидные компоненты обеспечивают высокое электрическое сопротивление мембраны, ее непроницаемость для ионов и полярных молекул и проницаемость для неполярных веществ. В частности, большинство анестезирующих препаратов хорошо растворяются в липидах, что позволяет им проникать через мембраны нервных клеток.

Ряд фосфатидов вместо аминосодержащего этерифицирующего агента содержит остатки многоатомных спиртов – глицерина, миоинозита и др. Приведенные ниже в качестве примера фосфатидилглицерины и фосфатидилинозиты относятся к кислым глицерофосфолипидам, поскольку в их структурах отсутствуют фрагменты аминоспиртов, придающие фосфатидилэтаноламинам и родственным соединениям нейтральный характер.

Менее распространены по сравнению со сложноэфирными глицерофосфолипидами липиды с простой эфирной связью, в частности плазмалогены. Они содержат остаток ненасыщенного спирта, связанный простой эфирной связью с атомом С-1 глицеро-3-фосфата, как, например, плазмалогены с фрагментом этаноламина – L-фосфатидальэтаноламины. Плазмалогены составляют до 10% всех липидов ЦНС.
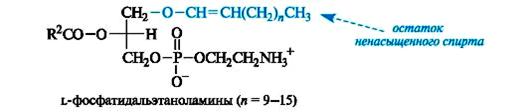
3. Приведите проекционные формулы стереоизомеров 2-амино-3-гидроксибутановой кислоты. Какая из формул соответствует L-треонину?
CH3 – CH – CH – COOH
| |
OH NН2
COОH COОH
 |  |

 H2N Н Н NH2
H2N Н Н NH2

 H OH HO H
H OH HO H
CH 3 CH3
L-треонин D-треонин
COОH COОH
 |  |

 H2N Н Н NH2
H2N Н Н NH2

 HO H H OH
HO H H OH
CH3 CH3
L-аллотреонин D-аллотреонин
 4. Напишите схему гидролиза цАМФ (cAMP) в кислой среде. Укажите сложноэфирные и гликозидные связи.
4. Напишите схему гидролиза цАМФ (cAMP) в кислой среде. Укажите сложноэфирные и гликозидные связи.
О
В молекуле цАМФ:
|
Сложноэфирная связь: – Р – О – СН2 –
||
О |
О-гликозидная связь: – Р – О – СН – (на схеме – длинная диагональная связь между фосфором и циклом).
N-гликозидная связь: – СН – N (на схеме – связь между рибофуранозным циклом и атомом азота). |
5. Осуществите превращения и назовите зашифрованные соединения.
CH3CH2CH3 →(Br2)→ A→(KOH)→ Б →[O]→ ацетон →(NH2OH)→ Г



Дата добавления: 2015-02-10; просмотров: 1896; Мы поможем в написании вашей работы!; Нарушение авторских прав |