
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Билет №21
1. Гидрокси- и аминокислоты. Реакции циклизации. Лактоны. Лактамы. Гидролиз лактонов, лактамов. Реакции элиминирования β-гидрокси- и β-аминокислот. Представление о строении β-лактамных антибиотиков.
Гидроксикислотами называют соединения, содержащие в молекуле одновременно гидроксильную и карбоксильную группы. Аминокислоты содержат в молекуле аминогруппу и карбоксильную группу.
В алифатическом ряду по взаимному расположению функциональных групп различают α-, β-, γ- и т. д. гидрокси- и аминокислоты. Буквой греческого алфавита указывают положение другой функциональной группы относительно карбоксильной, при этом отсчет ведется от ближайшего к карбоксильной группе атома углерода, т.е. от атома С-2. Отметим, что в заместительной номенклатуре для замещенных карбоновых кислот локанты α-, β-, γ- и т. д. не употребляются.
В гетерофункциональных соединениях в зависимости от природы функциональных групп и их местоположения в молекуле возможно усиление или, наоборот, ослабление некоторых свойств, характерных для монофункциональных соединений. Например, кислотность гидроксикислот выше, чем незамещенных кислот. Аминокислоты, содержащие одновременно кислотные и основные фунциональные группы, проявляют амфотерные свойства, т.е. способность взаимодействовать как с кислотами, так и с основаниями. В нейтральных водных растворах или кристаллическом состоянии аминокислоты существуют преимущественно в форме внутренних солей (диполярных ионов), как показано на примере γ-аминомасляной кислоты.

У α-гидроксикислот и α-аминокислот функциональные группы близки, но внутримолекулярного взаимодействия между ними не происходит из-за неустойчивости трехчленных циклов, которые могли бы при этом образоваться. При нагревании α-гидрокси- и α-аминокислоты претерпевают межмолекулярную циклизацию с образованием продуктов, называемых соответственно лактидами и дикетопиперазинами (последнее – от названия шестичленного гетероцикла с двумя атомами азота – пиразина).
Лактиды содержат две сложноэфирные группы, дикетопиперазины – две амидные группы.

Лактиды и дикетопиперазины, являясь сложными эфирами или амидами соответственно, в условиях кислотного или основного катализа способны гидролизоваться с образованием исходных α-гидрокси- или α-аминокислот.
Особое свойство α-гидроксикислот заключается в их способности разлагаться при нагревании в присутствии минеральных кислот с образованием карбонильных соединений и муравьиной кислоты.

β-Гидрокси- и β-аминокислоты.Характерное общее свойство этих гетерофункциональных кислот заключается в способности к элиминированиюмолекулы воды или соответственно аммиака с образованием α,β-ненасыщенных кислот.

Реакции элиминирования протекают в мягких условиях. Это объясняется высокой протонной подвижностью α-атома водорода, обусловленной электронным влиянием двух электроноакцепторных групп (Х и СООН).

γ-Гидрокси- иγ-аминокислоты.Эти кислоты, как и кислоты с δ-расположением функциональных групп, при нагревании претерпевают внутримолекулярную циклизацию. Из гидроксикислот при этом образуются циклические сложные эфиры – лактоны, из аминокислот - циклические амиды – лактамы. Лактоны легко образуются уже при незначительном нагревании, а также в кислой среде.

Принципиально так же происходит внутримолекулярное взаимодействие амино- и карбоксильной групп в γ- и δ-аминокислотах.

Лактоны и лактамы, будучи соответственно сложными эфирами и амидами, гидролизуются в кислой или щелочной среде.
β-лактамные антибиотики — группа антибиотиков, которые объединяет наличие в структуре β-лактамного кольца.
В β-лактамам относятся подгруппы пенициллинов, цефалоспоринов, карбапенемов и монобактамов. Сходство химической структуры предопределяет одинаковый механизм действия всех β-лактамов (нарушение синтеза клеточной стенки бактерий), а также перекрёстную аллергию к ним у некоторых пациентов.
С учётом высокой клинической эффективности и низкой токсичности β-лактамные антибиотики составляют основу антимикробной химиотерапии на современном этапе, занимая ведущее место при лечении большинства инфекций.
 1 – пенициллины;
1 – пенициллины;
2 – цефалоспорины.
β-лактамное кольцо выделено красным
2. Стероиды. Представление об их биологической роли. Гонан (стеран). Конформационное строение 5α- и 5β-стеранового скелета. Углеводороды – родоначальники групп стероидов: эстран, андростан, прегнан, холан, холестан.
Стероиды широко распространены в природе и выполняют в организме человека разнообразные функции, в том числе являются биорегуляторами. Наряду с использованием природных стероидов синтетически получено множество физиологически активных веществ стероидной природы.
В основе структуры стероидов лежит скелет гонана, состоящий из конденсированных, нелинейно сочлененных циклогексановых колец А, В и С и циклопентанового кольца D. Общая структура стероидов и принятый порядок нумерации атомов приведены ниже.

Большинство природных стероидов имеет в стероидном скелете следующие заместители:
• «ангулярные» («угловые») метильные группы у атомов С-10 (СН3-19) и С-13 (СН3-18);
• алифатический заместитель R у атома С-17;
• кислородсодержащий заместитель у атома С-3 (OH, OR', оксогруппа).
По числу атомов углерода в радикале R стероиды делятся на группы, приведенные в таблице (кроме сердечных гликозидов и экдистероидов).
Классификация стероидов по величине углеводородного радикала у С-17

Гонан содержит 6 узловых асимметрических атомов углерода. С введением заместителей к любым неузловым атомам число возможных стереоизомеров еще более возрастает. Тем не менее, из-за высокой стереоселективности реакций, лежащих в основе биогенеза стероидов, в живой природе встречаются только некоторые из возможных стереоизомерных форм.
Сочленение между собой попарно колец А и В, В и С, С и D может осуществляться по транс-типу. Типы сочленения колец А и В можно продемонстрировать на примере бициклического углеводорода декалина, являющегося фрагментом структуры гонана.
В зависимости от конфигурации атомов С-9 и С-10 декалин может существовать в виде двух стереоизомеров: транс-декалина, у которого атомы водорода у атомов С-9 и С-10 находятся по разные стороны от условной плоскости колец, и цис-декалина с расположением атомов водорода у этих атомов углерода по одну сторону плоскости.

Стереоизомерные декалины различаются по термодинамической стабильности: цис-декалин обладает более высокой энергией, чем транс-декалин, поэтому в стероидах более распространен транс-сочлененный декалиновый фрагмент.
В целом для природных стероидов характерно транс-сочленение колец В и С и преимущественно транс-сочленение колец С и D, а кольца А и В могут иметь как транс-, так и цис-сочленение. Все циклогексановые кольца находятся в конформации кресла.
В структурных формулах стероидов положение атомов водорода и заместителей снизу или сверху от условной плоскости кольца обозначают буквами α и β соответственно (что напоминает обозначения в углеводах). Стереохимию сочленения колец А и В указывают по ориентации атома водорода в положении 5. Так, 5α-стероид имеет транс-, а 5β-стероид - цис-сочленение колец А и В.

При обычном написании формул стероидов циклический скелет принято изображать плоским. Заместители и атомы водорода в таком случае будут располагаться либо под плоскостью чертежа (α-ориентация), либо над нею (β-ориентация).

Углеводороды – родоначальники групп стероидов:
-  - его производными являются важнейшие эстрогены – эстрон и эстрадиол;
- его производными являются важнейшие эстрогены – эстрон и эстрадиол;
-  - его производными являются два основных мужских половых гормона – андростерон и тестостерон;
- его производными являются два основных мужских половых гормона – андростерон и тестостерон;
- 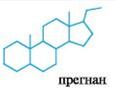 - основа кортикостероидов – группы стероидных гормонов, образующихся в корковом веществе надпочечников;
- основа кортикостероидов – группы стероидных гормонов, образующихся в корковом веществе надпочечников;
- 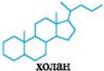 - основа желчных кислот;
- основа желчных кислот;
-  - основа стеринов.
- основа стеринов.
3. Объясните механизм образования этилена из этанола в присутствии катализатора – концентрированной H2SO4.
H
|
CH3 – CH2 – OH →(H+)→ CH3 – CH2 – O+– H →(-H2O)→ CH3 – CH2+ →
→(- H+)→ CH2 = CH2
4. Напишите уравнение реакции лейцина с азотистой кислотой. В чём сущность окислительного и неокислительного дезаминирования α-аминокислот?
Неокислительное дезаминирование происходит с участием ферментов в живых организмах и образуются α,β непредельные кислоты.
Процесс окислительного дезаминрования в организме может осуществляться с участием ферментов дегидрогеназ и кофермента НАД+ или НАДВ+. Например, при окислительном дезаминировании L-глутаминовой кислоты образуется α-оксоглутаровая кислота. На первой стадии осуществляется дегидрирование (окисление) глутаминовой кислоты до α-иминоглутаровой кислоты. На второй стадии происходит гидролиз, в результате которого получаются α-оксоглутаровая кислота и аммиак. Стадия гидролиза протекает без участия фермента. Образующийся аммиак включается в цикл мочевины.
В лабораторных условиях эта реакция осуществляется при действии азотистой кислоты на α-аминокислоты (см. 4.3). При этом образуется соответствующая α-гидроксикислота и выделяется газообразный азот, по объему которого судят о количестве вступившей в реакцию аминокислоты (метод Ван-Слайка).

HOOC – CH – CH2 – CH – CH3 + HNO2à HOOC – CH – CH – CH2 – CH3+
| | | |
NH2 CH3 OH CH3
+ N2 + H2O
5. Окислите D-маннозу бромной водой. Покажите превращение продукта окисления в лактон.
OH OH
| |
HO – CH2 – CH – CH – CH – CH – CH = O →(Br2, H2O)→
| |
OH OH
OH OH
| |
→(Br2, H2O)→ HO – CH2 – CH – CH – CH – CH – COOH
| |
OH OH
OH OH
| | H
 HO – CH2 – CH – CH – CH – CH – COOH → CH2 – CH – C–––
HO – CH2 – CH – CH – CH – CH – COOH → CH2 – CH – C–––
| | | OH OH
OH OH O
| OH OH
O = C – CH – C ––––
H
Дата добавления: 2015-02-10; просмотров: 2234; Мы поможем в написании вашей работы!; Нарушение авторских прав |