
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Билет №22
1. Альдегидо- и кетонокислоты (глиоксиловая, пировиноградная, фосфоенилпируват, ацетоуксусная, щавелевоуксусная, α-оксоглутаровая). Реакции декарбоксилирования β-кетонокислот и окислительного декарбоксилирования α-кетонокислот. Кетоенольная таутомерия.
Оксокислотами называют соединения, содержащие в молекуле одновременно карбоксильную и альдегидную (или кетонную) группы. В соответствии с этим различают альдегидокислоты и кетонокислоты.
Простейшей альдегидокислотой является глиоксалевая (глиоксиловая) кислота, которая обычно существует в виде гидрата (НО)2СНСООН. Она содержится в недозрелых фруктах, но по мере созревания ее количество уменьшается.
Важную роль в биохимических процессах играют кетонокислоты – пировиноградная, ацетоуксусная и щавелевоуксусная.
Пировиноградная кислота является одним из промежуточных продуктов молочнокислого и спиртового брожения углеводов. Своим названием пировиноградная кислота обязана тому, что впервые была выделена при пиролизе виноградной кислоты.
Пировиноградная кислота декарбоксилируется при нагревании с разбавленной и декарбонилируется (отщепляет СО) – с концентрированной серной кислотой.

При ферментативном декарбоксилировании пировиноградной кислоты получается ацетальдегид, связанный с коферментом («активный ацетальдегид»). Он может окисляться в присутствии кофермента А в ацетилкофермент А.
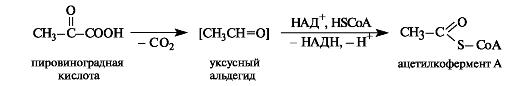
Производным пировиноградной кислоты является фосфоенолпировиноградная кислота (фосфат енольной формы кислоты). В организме анион этой кислоты – фосфоенолпируват – образуется в процессе гликолиза и служит предшественником пирувата.

Щавелевоуксусная кислота одновременно является α- и β-оксокислотой. Она образуется при окислении яблочной кислоты.
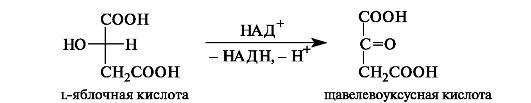
Далее щавелевоуксусная кислота при конденсации с ацетилкоферментом А превращается в лимонную кислоту.
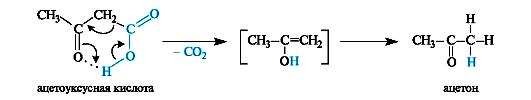
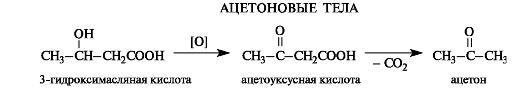
Ацетоуксусная кислота – представитель β-оксокислот. В свободном состоянии представляет сиропообразную жидкость, медленно выделяющую диоксид углерода.
Как продукт окисления 3-гидроксимасляной кислоты наряду с продуктами ее превращений накапливается в организме больных сахарным диабетом (так называемые ацетоновые, или кетоновые тела).
Большое теоретическое значение в связи с вопросами таутомерии и двойственной реакционной способности имеет этиловый эфир ацетоуксусной кислоты, называемый просто ацетоуксусным эфиром.
Ацетоуксусный эфир – жидкость с приятным фруктовым запахом. Впервые синтезирован более 100 лет назад, его строение долгое время было предметом острых дискуссий. Основная трудность заключалась в том, что в результате его химических превращений получались два ряда производных - ацетоуксусной и 3-гидроксикротоновой кислот, т. е. ацетоуксусный эфир проявлял двойственную реакционную способность.
Исследования показали, что ацетоуксусный эфир представляет собой смесь двух изомеров – кетона (92,5%) и енола (7,5 %), находящихся в таутомерном равновесии. Это пример кето-енольной таутомерии.

При действии на ацетоуксусный эфир какого-либо реагента в реакцию вступает один из таутомеров. Поскольку второй таутомер в результате равновесия восполняет убыль реагирующего таутомера, таутомерная смесь реагирует в данном направлении как одно целое.
Анион α-оксоглутаровой кислоты, α-оксоглутарат — важное биологическое соединение. Это кетокислота, которая образуется при дезаминировании глутамата. Α-оксоглутарат является одним из соединений, образущихся в цикле Кребса.
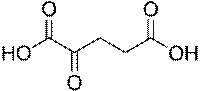
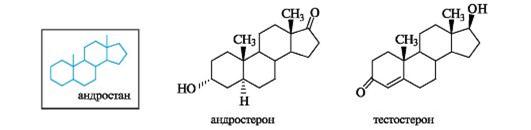
2. Стероидные гормоны. Эстрогены (эстрон, эстрадиол), андрогены (андростерон, тестостерон), гестагены (прогестерон), кортикостероиды (кортикостерон, преднизолон).
Кортикостероиды – группа стероидных гормонов, образующихся в корковом веществе надпочечников. Основу их структуры составляет углеводород прегнан. Боковая цепь в кортикостероидах у атома С-17 включает два атома углерода в виде группировки -CO-CH2OH.
Кортикостероиды можно разделить на две группы: минералокортикостероиды, регулирующие водный и солевой обмены.
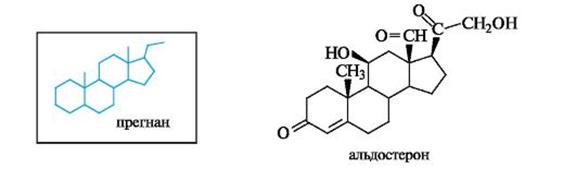
Глюкокортикостероиды оказывают противовоспалительное, противошоковое, антиаллергическое действие. Их получают либо из коркового слоя надпочечников крупного рогатого скота, либо синтетически и используют при лечении бронхиальной астмы, экзем, инфекционного гепатита, артритов. Примерами служат кортикостерон ипреднизолон, структурной характеристикой которых является система α, β-ненасыщенного кетона в кольце А.
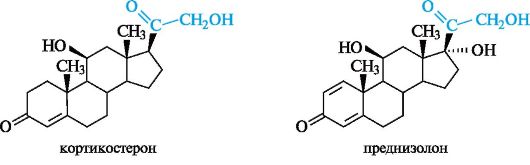
Кортикостерон действует как антагонист инсулина, повышая содержание глюкозы в крови. Преднизолон представляет собой синтетический кортикостероид, по действию превосходящий природные аналоги.
Половые гормоны вырабатываются половыми органами и регулируют половые функции. К их числу относятся женские (гестагены и эстрогены) и мужские половые гормоны (андрогены).
Гестагены образуются в желтом теле яичников (гормоны беременности). Гестагены, как и кортикостероиды, являются производными прегнана. Наибольшей активностью среди них обладает прогестерон, боковая цепь которого содержит два атома углерода.
Эстрогены контролируют менструальный цикл у женщин, используются при лечении климактерических расстройств, гипертонии и других заболеваний. Наиболее важны эстрон и эстрадиол – производные углеводорода эстрана. В отличие от всех других групп стероидов, эстрогены содержат ароматическое кольцо А.

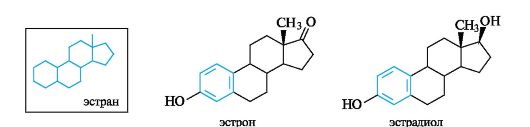
Эстрогены содержатся и в растениях - кокосовых орехах, цветках ивы и др. В настоящее время для медицинских целей эстроген получают путем промышленного химического синтеза.
Андрогены стимулируют развитие вторичных мужских половых признаков и выработку спермы, влияют на эндокринную систему человека, дают сильный анаболический эффект. Основные мужские половые гормоны -андростерон и более активный тестостерон. В основе их структуры лежит скелет углеводорода андростана. Боковая цепь у атома С-17 у этих кетостероидов, как и у эстрогенов, отсутствуе, но сохраняются обе «ангулярные» метильные группы.
3. Составьте уравнение реакции декарбоксилирования гистидина.

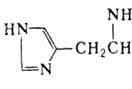

+ СО2
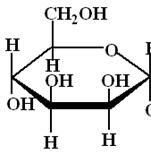
4. Напишите уравнение реакции глюкозы с пропанолом-1. Объясните конформационное строение образующихся аномеров.
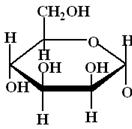
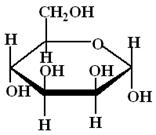
+ CH3 – CH2 – CH2 – OH → +
С3Н7
ОС3Н7
+ +Н2О
Н
В объяснении образования двух аномеров для удобства почти весь цикл опустим, рассмотрим только один, интересующий нас атом углерода.
Н
Н Н ..Н О+С3Н7
| + Н+ → | →(-Н2О)→ +~Н →(+С3Н7ОН)→ | + |→(-Н+)→ Конечная
ОН ОН ОС3Н7 Н смесь
Н+ Н+
Смесь аномеров в данном случае образуется потому, что присоединение спирта возможно как «сверху», так и «снизу».
5. Систематическое название одной из желчных кислот - 3α,7α-дигидрокси-5β-холан-24-овая кислота. Приведите её структуру.

Для понимания принципов составления систематических наименований подобных соединений рекомендуется ознакомиться со вторым вопросом 21 билета.
Дата добавления: 2015-02-10; просмотров: 1973; Мы поможем в написании вашей работы!; Нарушение авторских прав |