
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Билет №9
1. Реакции свободнорадикального замещения. Гомолитические реакции с участием sp3-гибридизированного атома углерода. Галогенирование, окисление кислородом. Региоселективность свободнорадикального замещения в аллильных и бензильных системах. Пероксидное окисление фрагментов жирных кислот в клеточных мембранах.
Углеводородам наиболее характерны следующие реакции: радикального замещения (SR, характерны для насыщенных углеводородов), электрофильного присоединения (AE, для ненасыщенных), электрофильного замещения (SE, для ароматических). Эти же реакции часто свойственны производным углеводородов, т.е. соединениям других классов, содержащих углеводородные фрагменты.
В большинстве гетеролитичских реакций алканы инертны, т.к. для них характерны неполярные Сsp3 – Сsp3 и практически неполярные Сsp3 – H σ-связи, достаточно прочные и не склонные к гетеролитическому разрыву под действием электрофильных или нуклеофильных агентов (под гетеролитическим разрывом следует понимать разрыв, идущий по ионному механизму, т.е. с образованием двух ионов: катиона и аниона). Возможными для них являются радикальные процессы, в которых участвуют обладающие высокой энергией весьма реакционноспособные радикальные частицы. Аналогично ведут себя ненапряжённые циклические насыщенные углеводороды, в частности циклоалканы с обычным, средним и большим размером цикла (т.е. все циклоалканы, кроме циклопропана и циклобутана, в молекулах которых присутствует сильное угловое напряжение).
Существуют общие пути генерирования радикальных частиц: термолиз (расщепление ковалентной связи за счёт тепловой энергии при нагревании от 500ºС и выше; в частности, сюда относят крекинг-процесс), фотолиз (расщепление за счёт лучистой энергии, например, видимый или ультрафиолетовый свет) и химический путь (образование свободных радикалов в окислительно-восстановительных процессах; например, взаимодействие ионов металлов переменной валентности, Fe2+ в частности, с молекулярным кислородом и гидропероксидами).
Типичным примером фотолиза может служить галогенирование насыщенных углеводородов при облучении. Как и большинство реакций, идущих по механизму свободнорадикального замещения, эта реакция включает в себя несколько стадий:
- инициирование:

- рост цепи:
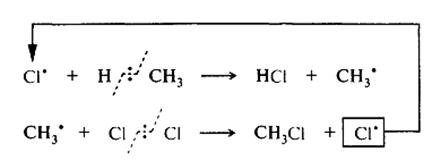
- обрыв цепи (может завершиться в результате ряда реакций, ниже приведены все возможные варианты):

Галогенирование алканов, содержащих неэквивалентные (неравноценные) атомы водорода, приводит к смесям изомерных продуктов замещения. Соотношение между ними зависит от природы реагента и субстрата, а также от условий реакции. В качестве примера рассмотрим моногалогенирование пропана.

При высоких температурах (500-600ºС) радикал хлора настолько активен, что действует неизбирательно, отрывая водород от любой связи С – Н. При этом наблюдается соотношение продуктов реакции 3:1 соответственно в том порядке, в котором они указаны, что доказывает неизбирательность действия атома хлора. В более мягких условиях наблюдается соотношение продуктов реакции 2:3. Ещё большую избирательность проявляет менее реакционноспособный радикал брома (в силу его большей стабильности).
Более высокая селективность менее активного реагента (в нашем случае – радикала брома) по сравнению с более активным агентом (радикал хлора) – общая закономерность в протекании органических реакций.
Таким образом, преимущественной радикальной атаке подвергаются атомы водорода не у первичного, а у вторичного атома углерода. Ещё легче происходит отрыв атома водорода от третичного атома углерода. Особенно легко происходит разрыв связи С – Н в случае образования радикалов, стабилизированных путём делокализации неспаренного электрона в сопряжённой системе, например, радикала аллильного  и бензильного
и бензильного  типов. Именно лёгкостью промежуточного образования бензильных радикалов объясняется способность толуола галогенироваться по метильной группе в мягких условиях.
типов. Именно лёгкостью промежуточного образования бензильных радикалов объясняется способность толуола галогенироваться по метильной группе в мягких условиях.

Региоселективность — явление, при котором в химической реакции один путь разрыва и образования связей преобладает над остальными возможными путями.
Один из важнейших процессов – взаимодействие органических соединений с молекулярным кислородом. Молекула кислорода представляет собой бирадикал  и может реагировать с соединениями, содержащими связи C – H, по радикальному механизму с образованием гидропероксидов или продуктов их дальнейших превращений.
и может реагировать с соединениями, содержащими связи C – H, по радикальному механизму с образованием гидропероксидов или продуктов их дальнейших превращений.
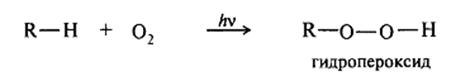

Если реакция происходит под действием атмосферного кислорода, то реакция называется автоокислением (например, автоокисление простых эфиров):

Следует учитывать, что пероксиды и гидропероксиды взрывоопасны.
Как и при галогенировании, в реакциях с кислородом активны аллильные, бензильные и атомы водорода при третичном атоме углерода.
Окисление органических соединений может происходить и в условиях организма. К таким процессам относится пероксидное окисление липидов. Для протекания этих реакций важно начальное появление в системе свободных радикалов, которые могут возникать, в частности, за счёт взаимодействия ионов металлов переменной валентности либо с молекулярным кислородом, либо с гидропероксидами.

Далее с участием образовавшихся радикальных частиц (обозначим их Х·) следуют обычные стадии цепного процесса:

Образующиеся in vivo пероксидные радикалы  сравнительно малоактивны, поэтому они реагируют довольно избирательно, атакуя, например, лишь связи С – Н в аллильном фрагмента и связи О – Н в некоторых фенолах. В последнем случае образуются малоактивные радикалы, неспособные вступать в реакцию с новой молекулой RH, и цепной процесс прерывается. Поэтому фенолы, в частности α-токоферол, играют в пероксидном окислении роль антиоксидантов.
сравнительно малоактивны, поэтому они реагируют довольно избирательно, атакуя, например, лишь связи С – Н в аллильном фрагмента и связи О – Н в некоторых фенолах. В последнем случае образуются малоактивные радикалы, неспособные вступать в реакцию с новой молекулой RH, и цепной процесс прерывается. Поэтому фенолы, в частности α-токоферол, играют в пероксидном окислении роль антиоксидантов.
Пероксидное окисление липидов – один из наиболее важных окислительных процессов в организме. Он является основной причиной повреждения клеточных мембран (например, при лучевой болезни). Структурные фрагменты ненасыщенных высших жирных кислот в фосфолипидах служат мишенью для атаки активными формами кислорода (далее АФК).
При атаке, в частности, гидроксильным радикалом HO', наиболее активным из АФК, молекулы липида LH происходит гомолитический разрыв связи С-Н в аллильном положении, как показано на примере модели пероксидного окисления липидов. Образующийся радикал аллильного типа L' мгновенно реагирует с находящимся в среде окисления молекулярным кислородом с образованием липидпероксильного радикала LOO'. С этого момента начинается цепной каскад реакций пероксидации липидов, поскольку происходит постоянное образование аллильных липидных радикалов L', возобновляющих этот процесс.

Липидные пероксиды LOOH – неустойчивые соединения и могут спонтанно или при участии ионов металлов переменной валентности разлагаться с образованием липидоксильных радикалов LO', способных инициировать дальнейшее окисление липидного субстрата. Такой лавинообразный процесс пероксидного окисления липидов представляет собой опасность разрушения мембранных структур клеток.
2. O- и N-гликозиды. Гидролиз гликозидов. Фосфаты моносахаридов. Ацилирование моносахаридов. Окисление моносахаридов. Восстановительные свойства альдоз. Гликоновые, гликаровые, гликуроновые кислоты. Аскорбиновая кислота. Восстановление моносахаридов (ксилит, сорбит, манит).

К гликозидам относят производные циклических форм углеводов, в которых полуацетальная гидроксильная группа заменена группой OR. Неуглеводный компонент гликозида называют агликоном. Связь между аномерным центром (в альдозах это С-1, в кетозах – С-2) и группой OR называют гликозидной. Гликозиды являются ацеталями циклических форм альдоз или кетоз.
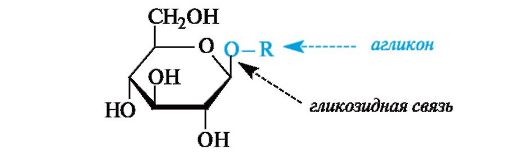
В зависимости от размера оксидного цикла гликозиды подразделяют на пиранозиды и фуранозиды. Гликозиды глюкозы называют глюкозидами, рибозы – рибозидами и т. п. В полном названии гликозидов последовательно указывают наименование радикала R, конфигурацию аномерного центра (α- или β-) и название углеводного остатка с заменой суффикса -оза на -озид.
Гликозиды образуются при взаимодействии моносахаридов со спиртами в условиях кислотного катализа; при этом в реакцию вступает только полуацетальная группа ОН.

Гликозиды подразделяются на O-гликозиды и N-гликозиды. N-гликозиды, называемые также гликозиламинами, представляют собой производные циклических форм сахаров, построенные аналогично обычным гликозидам, но гликозидная связь осуществляется в них не атомом кислорода, как в О-гликозидах, а атомом азота.
Растворы гликозидов не мутаротируют (мутаротация – изменение величины оптического вращения растворов оптически активных соединений вследствие их эпимеризации, в химии углеводов под мутаротацией обычно подразумевается аномеризация полуацетального атома углерода).
Превращение моносахарида в гликозид – сложный процесс, протекающий через ряд последовательных реакций. В общих чертах он аналогичен получению ациклических ацеталей. Однако вследствие обратимости реакции в растворе в равновесии могут находиться таутомерные формы исходного моносахарида и четыре изомерных гликозида (α- и β-аномеры фуранозидов и пиранозидов).
Как и все ацетали, гликозиды гидролизуются разбавленными кислотами, но проявляют устойчивость к гидролизу в слабощелочной среде. Гидролиз гликозидов приводит к соответствующим спиртам и моносахаридам и представляет собой реакцию, обратную их образованию. Ферментативный гидролиз гликозидов лежит в основе расщепления полисахаридов, осуществляемого в животных организмах.
Моносахариды легко ацилируются ангидридами органических кислот, образуя сложные эфиры с участием всех гидроксильных групп. Например, при взаимодействии с уксусным ангидридом получаются ацетильные производные моносахаридов. Сложные эфиры моносахаридов гидролизуются как в кислой, так и в щелочной средах.

Большое значение имеют эфиры неорганических кислот, в частности эфиры фосфорной кислоты – фосфаты. Они содержатся во всех растительных и животных организмах и представляют собой метаболически активные формы моносахаридов. Наиболее важную роль играют фосфаты D-глюкозы и D-фруктозы.

Эфиры серной кислоты – сульфаты – входят в состав полисахаридов соединительной ткани.
Реакции окисления используют для обнаружения моносахаридов, в частности глюкозы, в биологических жидкостях (моча, кровь).
В молекуле моносахарида окислению может подвергаться любой атом углерода, но легче всего окисляется альдегидная группа альдоз в открытой форме.
Мягкими окислителями (бромная вода) можно окислить альдегидную группу в карбоксильную, не затрагивая других групп. При этом образуются альдоновые кислоты. Так, при окислении d-глюкозы бромной водой получается D-глюконовая кислота. В медицине используется ее кальциевая соль – глюконат кальция.

Действие более сильных окислителей, таких, как азотная кислота, перманганат калия, и даже ионов Cu2+ или Ag+ приводит к глубокому распаду моносахаридов с разрывом углерод-углеродных связей. Углеродная цепь сохраняется только в отдельных случаях, например при окислении d-глюкозы в D-глюкаровую кислоту или D-галактозы в галактаровую (слизевую) кислоту.

Получающаяся галактаровая кислота трудно растворима в воде и выпадает в осадок, что используется для обнаружения галактозы указанным методом.
Альдозы легко окисляются комплексными соединениями меди (II) и серебра – соответственно реактивами Фелинга и Толленса. Такие реакции возможны в связи с присутствием альдегидной (открытой) формы в таутомерной смеси.

Благодаря способности восстанавливать ионы Cu2+ или Ag+ моносахариды и их производные, содержащие потенциальную альдегидную группу, называют восстанавливающими.
Гликозиды не проявляют восстановительной способности и не дают положительной пробы с этими реактивами. Однако кетозы способны восстанавливать катионы металлов, так как в щелочной среде они изомеризуются в альдозы.
Прямое окисление звена СН2ОН моносахаридов в карбоксильную группу невозможно из-за присутствия более склонной к окислению альдегидной группы, поэтому для превращения моносахаридав гликуроновую кислоту окислению подвергают моносахарид с защищенной альдегидной группой, например, в виде гликозида.

При окислении альдегидной группы образуются гликоновые (альдоновые) кислоты, которые по классификации не относятся к углеводам – это полигидроксикарбоновые кислоты. Окислению подвергается не карбонильная (оксо) форма, а циклическая, в виде полуацеталя, и образуется циклический эфир кислоты – лактон.
При действии на альдозы азотной кислотой образуются гликаровые (сахарные) кислоты, которые являются полигидроксидикарбоновыми кислотами. Они не являются углеводами. поскольку потеряли карбонильную группу.
НNO3 + СН2 – (СН2)4– СНО ——> НООС – (СН2)4– СООН
|
ОН
Аскорбиновая кислота (витамин С).Этот, пожалуй, старейший и самый популярный витамин по структуре близок к моносахаридам и представляет собой γ-лактон кислоты (I). Аскорбиновая кислота содержится во фруктах, особенно в цитрусовых, ягодах (шиповник, черная смородина), овощах, молоке. В больших масштабах производится в промышленности из D-глюкозы.

Аскорбиновая кислота проявляет довольно сильные кислотные свойства (рКа 4,2) за счет одной из гидроксильных групп ендиольного фрагмента. При образовании солей γ-лактонное кольцо не размыкается.
Аскорбиновая кислота обладает сильными восстановительными свойствами. Образующаяся при ее окислении дегидроаскорбиновая кислота легко восстанавливается в аскорбиновую. Этот процесс обеспечивает ряд окислительно-восстановительных реакции в организме.

При восстановлении моносахаридов (их альдегидной или кетонной группы) образуются альдиты.

Шестиатомные спирты – D-глюцит(сорбит) и D-маннит –получаются при восстановлении соответственно глюкозы и маннозы. Альдиты легко растворимы в воде, обладают сладким вкусом, некоторые из них (ксилит и сорбит) используются как заменители сахара для больных сахарным диабетом.
При восстановлении альдоз получается лишь один полиол, при восстановлении кетоз – смесь двух полиолов; например, из D-фруктозы образуются D-глюцит и D-маннит.

3. Напишите проекционные формулы стереоизомеров яблочной (гидроксиянтарной) кислоты. Назовите их по заместительной номенклатуре ИЮПАК.
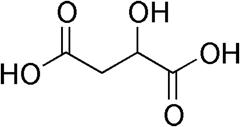
COОH COОH
 |

 H ОН НО H
H ОН НО H
 CH2COОH CH2COОH
CH2COОH CH2COОH
D-2-гидроксибутандиовая кислота L-2-гидроксибутандиовая кислота
4. Бензилбензоат C6H5COOCH2C6H5 – средство, применяемое против чесотки. Напишите уравнение его гидролиза в условиях кислотного катализа.

 . О
. О
| |
– С – О – СН2 – → (Н2SO4 (конц.)) →


→ – СООН + – СН2 – ОН
5. Напишите уравнение реакций внутримолекулярной конденсации γ-гидроксимасляной и γ-аминомасляной кислот. Назовите продукты реакции.
CH2 –––––– C = O
| |
HO – CH2 – CH2 – CH2 – COOH → (Н2SO4 (конц.)) → CH2 – CH2 – O + H2O
4-бутанолид
CH2 –––––– С = O
| |
H2N – CH2 – CH2 – CH2 – COOH → (Н2SO4 (конц.)) → CH2 – CH2 – NH + H2O
1-оксотетригидропиррол (1-оксопирролидин)
Дата добавления: 2015-02-10; просмотров: 1997; Мы поможем в написании вашей работы!; Нарушение авторских прав |