
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Гравиметрический метод
Суть метода - определение массы и процентного содержания какого-либо элемента, иона или химического соединения, находящегося в испытуемой пробе. Искомую часть выделяют либо в чистом виде, либо в виде соединения известного состава. Гравиметрическим методом определяют содержание ряда тяжелых металлов, анионов, сухого вещества в плодах и овощах, клетчатки, «сырой» золы в растительном материале. Кроме того, этим методом определяют кристаллизационную воду в солях, общую и гигроскопическую влажность почвы и т.д.
Гравиметрический анализ проводят по следующим стадиям:
- отбор средней пробы и подготовка ее к анализу;
- взятие навески;
- растворение навески;
- выбор осадителя и осаждение определяемого элемента (с пробой на полноту осаждения);
- фильтрование;
- промывание осадка (с пробой на полноту промывания);
- высушивание и прокаливание осадка;
- взвешивание;
- вычисление результатов анализа.
Аналитической практикой установлено, что при проведении гравиметрического анализа наиболее удобны навески от 0,5 до 2,0 г. Навеску вещества следует брать из расчета, чтобы после прокаливания получить гравиметрическую форму массой около 0,1-0,3 г для аморфного осадка и массой около 0,5 г - для кристаллического.
Титриметрический (объемный)метод
Этот метод имеет ряд преимуществ перед гравиметрическим (быстрота анализа, относительная простота операций, достаточная точность), в связи с чем он довольно широко применяется в лабораторной практике. В этом виде анализа взвешивание заменяется измерением объемов как определяемого вещества, так и реагента, используемого при данном определении. Если требуется провести объемным методом анализ сухого вещества, то берут его точную навеску массой 0,1-0,2 г, растворяют в мерной колбе, перемешивают, пипеткой отбирают известный объем полученного раствора, при необходимости добавляют буферную смесь, индикатор и пр. и проводят титрование.
Методы титриметрического анализа разделяют на 4 группы.
Методы кислотно-основного титрования. В основу этих методов положены реакции нейтрализации. Точка эквивалентности фиксируется при помощи индикаторов, которые меняют свою окраску в зависимости от реакции среды (величины рН). Этими методами определяют концентрации кислот, щелочей и солей, нейтрализующихся в водных растворах. В качестве рабочих растворов используют титрованные растворы кислот и сильных оснований.
Методы осаждения. Методом осадительного титрования определяют элемент, который, взаимодействуя с титрованным раствором, может осаждаться в виде малорастворимого соединения; при этом изменяются свойства среды, что позволяет установить точку эквивалентности.
Методы окисления-восстановления. Эти методы основаны на окислительно-восстановительных реакциях, которые протекают между искомым веществом и веществом рабочего раствора (перманганатометрия, йодометрия, хроматометрия и др.). Их используют для обнаружения различных восстановителей (Fe2+, 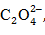
 и др.) или окислителей (
и др.) или окислителей (  ,
,  ,
,  , Fe3+ и т.д.). Точка эквивалентности определяется по изменению окраски либо самого раствора, либо редокс-индикатора.
, Fe3+ и т.д.). Точка эквивалентности определяется по изменению окраски либо самого раствора, либо редокс-индикатора.
Методы комплексообразования.Эти методы дают возможность определять целый ряд катионов (Mg2+, Са2+, Zn2+, Hg2+, Al3+ и др.) и анионов (CN–, F–, C1–), которые обладают способностью образовывать малодиссоциированные комплексные ионы. Особый интерес представляет комплексон III (трилон Б), широко используемый в количественном анализе. Точку эквивалентности чаще всего устанавливают по исчезновению анализируемого катиона в растворе с помощью так называемых металл-индикаторов. В качестве индикаторов для определения суммарного содержания кальция и магния могут быть взяты эриохром черный Т и хромовый темно-синий, для обнаружения кальция - мурексид, железа - роданид аммония в сульфаниловой кислоте и т.д.
Дата добавления: 2015-04-11; просмотров: 382; Мы поможем в написании вашей работы!; Нарушение авторских прав |