
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Электрофильные реакции. Свойства VX как нуклеофильиого реагента обусловлены наличием свободных пap электронов на атомах азота и серы
Свойства VX как нуклеофильиого реагента обусловлены наличием свободных пap электронов на атомах азота и серы, благодаря которым ОВ обладает основностью по отношению к иону водорода и нуклеофильностью по отношению к другим соединениям. Конечно, основность и нуклеофильность у атомов азота и серы различны, поэтому в одних реакциях VX выступает как типичное основание, а в других — как нуклеофильный реагент.
С кислотами VX реагирует как основание и очень легко образует твердые аммониевые соли, растворимые в воде, спирте и многих полярных органических растворителях:
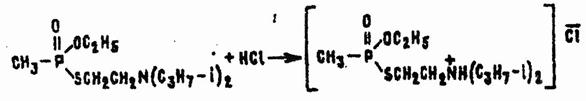
Продукты реакции по токсичности такие же, как и исходное ОВ, но они несколько быстрее гидролизуются, а главное — намного хуже проникают через кожу в кровяное русло. Этим можно воспользоваться для удаления VX с рук или поверхностей некоторых мелких предметов: достаточно обработать их раствором относительно сильной, но не слишком агрессивной к данной поверхности кислоты (например щавелевой или лимонной) и смыть образовавшуюся твердую ядовитую соль водой или подходящим растворителем. Ряд солей (например, соль VX с висмутйодистоводородной сислотой HBiI4) имеют характерную окраску, что используется в индикации отравляющих веществ группы V-газов.
Некоторые галоидные алкилы также взаимодействуют с VX с образованием твердых галоидалкилатов — четвертичных аммониевых солей, по токсичности превосходящих VX, но смываемых водой или спиртом, например:

Реакции VX с электрофильными реагентами происходят по схеме электрофильного присоединения к атому серы с образованием сульфониевых производных:

В продуктах присоединения связь Р—S ослабляется из-за смещения электронов, образующих ее, к положительно заряженному атому серы. Это влечет за собой увеличение дефицита электронной плотности на атоме фосфора и возрастание частичного положительного заряда. В итоге продукт реакции (2.23) легко подвергается нуклеофильной атаке, например, молекулой воды:

Электрофильные реакции в водных растворах лучше всего происходят при рН = 5—9. В частности, окислители взаимодействуют с VX с разрывом связи Р—S и образованием нетоксичных производных метилфосфоновой и эта нсульфо новой кислот по общей схеме:
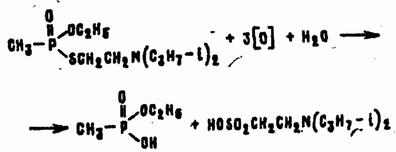
По приведенной схеме реагируют любые окислители: хлор в водном растворе, хлорамины, гипохлориты, перекись водорода и т. д. От природы окислителя зависит главным образом скорость реакции. На глубину же окисления влияют среда, температура и продолжительность реакции, соотношение компонентов.
Реакция VX с гипохлоритами щелочных и щелочноземельных металлов в отличие от реакции G-газов сильно зависит от концентрации водородных ионов и содержания катионов хлора Cl+ и в значительно меньшей степени от содержания ионов гипохлорита ClO-. В водных растворах гипохлоритов, имеющих слабокислую или нейтральную среду, VX взаимодействует сначала с катионом хлора:

Промежуточное соединение быстро гидролизуется с образованием этилового эфира метилфосфноновой кислоты и диизопропиламиноэтансульфенхлорида:

Последний также гидролитически неустойчив, но при достаточно высокой концентрации протонов в реакционной среде успевает прореагировать с другой молекулой VX, образуя сложное и нестабильное сульфониевое производное, гидролиз которого приводит к этилметилфосфонату и дисульфиду:

Дисульфид в условиях реакции окисляется до сульфохлорида, который сразу гидролизуется:

Реакции (2.24—2.27) требуют повышенного расхода гипохлорита, но слабокислой среде имеют достаточно высокую скорость и могут применяться для дегазации VX.
В щелочной среде катионы хлора отсутствуют, и реакция при комнатной температуре происходит медленнее:

Применительно к ДТС ПС уравнение принимает вид:

Хлорамины и другие вещества хлорирующего и окислительного действия в зависимости от их силы и условий реакции по-разному реагируют с VX. Водорастворимые монохлорамины в нормальных условиях непригодны для разложения VX из-за их недостаточной активности как окислителей. Они реагируют с VX только в кислых водных растворах, при достаточно высокой концентрации водородных ионов.
Хлорамины, нерастворимые в воде (дихлорамины, гексахлормеламин), хлористый сульфурил, хлор и другие хлорирующие средства в подходящих органических растворителях количественно разлагают VX на хлорангидрид этилового эфира метилфосфоновой кислоты и 2-диизопропиламинозтансульфенхлорид:

Продукты реакции нетоксичны и легко гидролизуются.
Дата добавления: 2015-04-15; просмотров: 370; Мы поможем в написании вашей работы!; Нарушение авторских прав |