
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Схема 4.1
В задаче указаны опытные данные по коллигативным свойствам раствора (либо осмотическое давление πoп, либо понижение давления насыщенного пара ΔР0П, либо понижение температуры замерзания ΔТз оп, либо повышение температуры кипения ΔТК 0П раствора).
1. Определяют концентрацию раствора (молярную, если дано осмотическое давление; моляльную, если дано изменение температуры замерзания или температуры кипения; молярную долю растворенного вещества (N2), если дано понижение давления насыщенного пара).
2. Теоретически рассчитывают величину либо осмотического давления πт, либо понижения давления насыщенного пара ΔРТ, либо понижения температуры замерзания ΔТЗТ, либо повышения температуры кипения ΔТКТ раствора по соответствующим формулам:
πт=CRT (4.2)
ΔРТ = N2 . P0 (4.3)
 (4.4)
(4.4)
ΔТЗТ = К3 .С (4.5)
ΔТКТ = КЭ .С, (4.6)
где R = 62,36 — константа, численно равная газовой постоянной, T- абсолютная температура, π — осмотическое давление (мм рт. ст.), N2 = 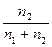 ; п1 ,п2 — число молей соответственно растворителя и растворенного вещества, Р0 — давление пара растворителя над чистым растворителем, ΔР / Р0 — относительное понижение давления насыщенного пара, Кз — криоскопическая постоянная (молярное понижение точки замерзания растворителя), Кэ — эбулиоскопическая постоянная (молярное повышение точки кипения растворителя), ΔТ3 — разность температур замерзания растворителя и раствора, ΔТК — разность температур кипения раствора и растворителя, С — соответствующая концентрация раствора.
; п1 ,п2 — число молей соответственно растворителя и растворенного вещества, Р0 — давление пара растворителя над чистым растворителем, ΔР / Р0 — относительное понижение давления насыщенного пара, Кз — криоскопическая постоянная (молярное понижение точки замерзания растворителя), Кэ — эбулиоскопическая постоянная (молярное повышение точки кипения растворителя), ΔТ3 — разность температур замерзания растворителя и раствора, ΔТК — разность температур кипения раствора и растворителя, С — соответствующая концентрация раствора.
3. Находят величину изотонического коэффициента Вант-Гоффа:
i=  (4.7)
(4.7)
4. Рассчитывают степень диссоциации α.
 (4.8)
(4.8)
где ν — число ионов, на которые диссоциирует молекула электролита.
Дата добавления: 2015-04-15; просмотров: 279; Мы поможем в написании вашей работы!; Нарушение авторских прав |