
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Схема 6.1
1.Составляют уравнения диссоциации комплексного электролита и внутренней сферы комплекса. Одновременно находят значение логарифма константы устойчивости комплекса (lg βn) по справочным таблицам (см. приложение 3) и переходят к величине константы нестойкости.
2. Записывают выражение константы нестойкости в соответствии с уравнением диссоциации внутренней сферы комплекса.
3. Приняв равновесную концентрацию комплексообразователя за х, записывают равновесные концентрации лиганда и комплекса. Затем подставляют их в уравнение константы нестойкости. Решая уравнение, находят концентрации продуктов диссоциации внутренней сферы комплекса.
Пример 6.2. Определите долю диссоциированной формы комплексного иона в 1 М растворе [Ag(NH3)2]Cl, если логарифм константы устойчивости комплексного иона составляет: lg β2 = 7,23.
Решение. Согласно схеме 6.1,
1. [Ag(NH3)2]Cl ↔[Ag(NH3)2]+ + 2Сl-.
[Ag(NH3)2]+↔Ag++2NH3, lgK1,2=7,23 (см. приложение 3), значит β2= 1,7 • 107. Согласно (6.3),
Кнест=  =5,9 . 10-8
=5,9 . 10-8
2. Кнест = 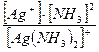
3.[Ag+]=х [NH3]= 2х, [Ag(NH3)2]+ = (l-x).
Кнест = 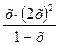 = 5,9 .10-8.
= 5,9 .10-8.
так как х< 1, можно упростить 4х3 = 5,9 • 10-8, отсюда х = 2,4 • 10-3, что соответствует [Ag+] = 2,4 . 10-3 моль/л, или 0,24%. Следовательно, доля диссоциированной формы комплексного иона составляет 2,4 • 10~3, или степень диссоциации равна 0,24%.
1. Какой комплекс из каждой указанной ниже пары устойчивее, чем это объясняется?
[Cd(NH3)4]2+ или [Cd(CN)4]2-; [Ag(NH3)2]+ или [Ag(N02)2]-; [Co(NH3)6]2+ или [Co(NH3)6]3+; [Ni(CN)4]2- или [Ni(NH3)4]2+.
2. Определите долю диссоциированной формы комплексного иона в 1 М растворах комплексных электролитов: [Cu(NH3)2]Cl; K[Au(CN)2]; [Zn(NH3)4]Br2.
3. Вычислите концентрацию комплексообразователя и лиганда в 1 Мрастворах комплексных соединений:
K2[Hg(CN)4]; Na2[Hg(N02)4]; [Co(NH3)6]Cl3; [Cu(NH3)6]Br.
Творческие задания
1. Выпадет ли осадок, если к 0,5 л 0,01 М раствора K[Ag(CN)2] прилить равный объем 0,01 М раствора KI?
2. Вычислите необходимую избыточную концентрацию цианида калия в растворе, для того чтобы при взаимодействии равных объемов 0,2 М растворов K[Ag(CN)2] и иодида калия в растворе не наблюдалось разрушение комплекса [Ag(CN)2]- и образование осадка AgI.
Занятие 5
Пример 7.1. В исследуемом растворе присутствуют ионы I- и Вг-. В какой последовательности они будут реагировать с КМп04 при рН 3 и рН б?
Решение. Окислительные свойства перманганата калия различны при различных значениях рН раствора.
1. Для полуреакции:
MnO4-+ 8H+ + 5 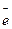 →Mg2+ + 4Н20, Е° MnO4-/Mn2+ = 1,51В
→Mg2+ + 4Н20, Е° MnO4-/Mn2+ = 1,51В
реальный стандартный потенциал системы соответствует:

При рН 3 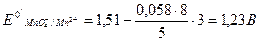
При рН 6 
2. Для полуреакций:
I2+2 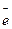 →2I-;
→2I-; 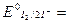 -0,54 В;
-0,54 В;
Вг2+2 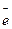 →2Вr-;
→2Вr-; 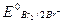 = 1,087 В.
= 1,087 В.
3. Учитывая зависимость реального стандартного потенциала восстановления перманганата от кислотности раствора, можно заключить, что при рН 3 оба иона (и I-, и Вг-) будут окисляться перманганатом, тогда как при рН б окисляется только ион I-.
Пример 7.2. Вычислите константу равновесия реакции:
Ce4++Fe2+↔Ce3++Fe3+.
Решение. 1. Справочные значения стандартных потенциалов для обеих редокс-пар следующие:
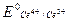 =1,74В;
=1,74В;  = 0,77В.
= 0,77В.
2. Используя приведенное выше уравнение для константы равновесия, получаем:
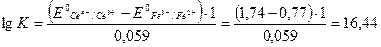
Следовательно, 
Большая величина константы равновесия (l016,44) свидетельствует о том, что данная реакция протекает слева направо. Самопроизвольное протекание этой реакции в указанном направлении подтверждается расчетом изменения свободной энергии Гиббса:
AG0 =-nFΔE° = -1. 96485 • (1,74 -0,77) = -93,6 кДж/моль.
Пример 7.3.Вычислите константу равновесия реакции:
H3AsO4 + 21- + 2Н+ ↔.H3AsO3 + I2 + Н20
в стандартных условиях и при концентрации ионов водорода в растворе [Н+]= 4 моль/л. Определите направление окислительно-восстановительного процесса в растворе с рН 8.
Решение. В стандартных условиях:
1. Справочные значения стандартных потенциалов для обеих редокс-пар следующие:
H3As04 + 2Н++ 2 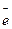 ↔H3As03 + Н20;
↔H3As03 + Н20; 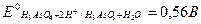
I2 + 2 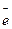 ↔2I-
↔2I- 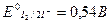
2. Используя приведенное выше уравнение для константы равновесия, получаем:
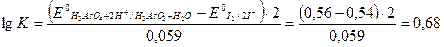
следовательно, К = 100,68 или К = 4,8.
Сравнительно небольшое значение константы равновесия (см. предыдущий пример, где К = 1016,44) свидетельствует о том, что равновесие в данном окислительно-восстановительном процессе можно легко смещать. Причем, так как потенциал полуреакции
H3As04 + 2Н++ 2 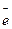 ↔H3As03 + Н20
↔H3As03 + Н20
зависит от рН раствора, а потенциал системы I2/2I-не зависит, то, меняя кислотность среды, можно увеличивать или уменьшать реальный потенциал только полуреакции восстановления арсената.
При концентрации ионов водорода в растворе [Н+] = 4 моль/л:
1. Для первой полуреакции вычисляем реальный окислительно-восстановительный потенциал:
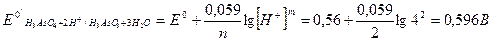
Для второй полуреакции: 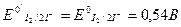
2. Используя приведенное выше уравнение для константы равновесия, получаем:
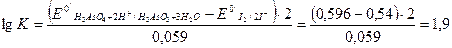
следовательно, К = 101,9 или К = 79,4.
Таким образом, при концентрации ионов водорода в растворе [Н+] = 4 моль/л равновесие в окислительно-восстановительном процессе смещено вправо, то есть реакция протекает в сторону восстановления арсената до арсенита.
В растворе с рН 8.
1. Для первой полуреакции вычисляем реальный стандартный потенциал:
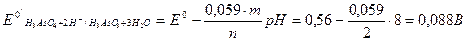
Для второй полуреакции:
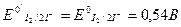
2. Поскольку 0,54 > 0,088, в данном случае более сильным окислителем является I2, а более сильным восстановителем — H3As03. Следовательно, можно заключить, что при рН 8 равновесие в исходном окислительно-восстановительном процессе смещено влево, то есть I2 окисляет As (III) в As (V):
H3AsO3 + I2 + Н,0 = H3AsO4 + 2I- + 2Н+.
3. Самопроизвольное протекание этой реакции в указанном направлении подтверждается расчетом изменения свободной энергии Гиббса:
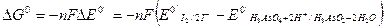
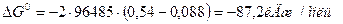
т.е. 
1. Укажите ионы, которые способны:
• восстанавливаться иодистоводородной кислотой;
• окисляться хлоратом калия:
Fe3+; Сг3+; Sn4+; Cu2+; Fe2+; Ag+; Co3+; I-,S042-; Cr2072-; Mn04-; N03-; IO3-.
2. Укажите среду, обоснуйте возможность и полноту протекания следующих реакций:
• в восстановление ионов N03- до оксида азота NO с помощью металлической меди;
• окисление ионов S032- в ионы S042- с помощью I2;
• окисление ионов Вг- до свободного брома с помощью хлорной воды;
• восстановление азотистой кислоты HN02 до оксида азота NO с помощью HI;
• окисление ионов N02- в ионы N03- с помощью ионов Мn04-;
• окисление ионов С1- до свободного хлора с помощью оксида марганца Мп02;
• окисление ионов Мn2+ в ионы Мn04- действием диоксида свинца РЬ02;
• окисление ионов Мn2+ в ионы Мn04- действием персульфата аммония (NH4)2S208;
• восстановление ионов N03- до оксида азота N0 с помощью ионов Fe2+;
• окисление иона Сг3+ в дихромат-ион Сг2072- действием персульфата аммония.
3. Укажите редокс-пару, на€ потенциал которой влияет рН среды: I/2I-; Fe3+/Fe2+; Cr2072-/Cr3+; Ce4+/Ce3+; S2082-/2S042-; Мn04-/Мn2+; As043-/As033-.
4. Подберите коэффициенты, определите направление реакций:
Mn2+ + NO3- + Н20 ↔ МпО4- + N02- + Н+;
Мn02 + ВгO- + ОН- ↔ МnО42- + Вг- + Н20;
Мn2+ + РЬ02 + H2S04 ↔ МnО4- + PbS04 + Н20;
МnО4- + CI- + Н+ ↔ Мn2+ + С12 + Н20;
Мn04- + I- + H+ ↔ Мn2+ +IO3-+ Н20;
Сг3+ + Вг2 + ОН- ↔ CrO42- + Вг- + Н20;
Sn2+ + МnО4- + Н+ ↔ Sn4+ + Мn2+ + Н20;
Fe3++H2S↔Fe2++ S + H+;
Сг(ОН)3 + Н202 + ОН- ↔ СгО42- + Н20;
NiS + HNO2+H+↔Ni2+ + S + NO + H20;
N03- + Mg + Н+ ↔ NH4+ + Mg2+ + Н20;
Мn02 + CI-+ Н+ ↔ Мn2+ + С12 + Н20;
Н+ + Cl-+ Н202 ↔ С12 + Н20.
Творческие задания
1. Вычислите константы равновесия для реакций, протекающих между следующими реагентами:
• I2 + Na2S203;
• FeS04 + KMn04 + H2S04;
• Na3As04 + KI + HCl;
• FeS04 + Ce(S04)2;
• Na2Cr207 + KI;
• FeCl3 + SnCl2;
• KMn04 + HCl;
• K2Cr207 + FeS04 + H2S04;
• H2S03 + I2 + H20;
• K2Cr207 + SnCl2;
• K2Mn04 + Cr2(S04)3.
2. Объясните график зависимости окислительного потенциала системы Мn04-/Мn2+ от рН среды. Определите по приведенному графику значения рН, при которых возможно восстановление ионов Мп04- ионами F-; Br-; C1- ?

|
3. Вычислите константы равновесия для реакций между веществами:
• Na2Cr207 + FeS04 при рН 3;
• НМn04 + Na3As03 npи [H+] = 2 моль/л;
• HMn04 + Na3AsO3 при рН 5;
• КМn04 + Na2S03 при рН 1;
• KMn04 + Na2S03 при [H+] = 2 моль/л;
• Cr(N03)3 + КМn04 при [Н+] = О,1 моль/л;
• H2S03 + I2 при рН 2;
• H2S03 + I2 при рН 5;
• Na2Cr207 + KI при рН 4.
Вопросы и задачи
1. Вчем сущность гравиметрического метода анализа?
2. Каким требованиям должны удовлетворять осадки в гравиметрическом методе анализа?
3. Какие условия необходимо создавать для получения крупнокристаллических осадков?
4. Какова ошибка взвешивания, если вместо 0,2175 найдена масса 0,2170?
Ответ. 0,23%.
5. Рассчитать относительную ошибку при определении серы в каменном угле, если вместо 3,12% найдено 3,05%.
Ответ. 2,2%.
6. Какие ошибки называются систематическими? случайными?
7. Какова масса железа в образце карбоната железа FeC03 в виде Fe и FeO, если путем растворения, окисления, осаждения и прокаливания его оно превращено в оксид железа (III) Fe203 массой 1,0000 г?
Ответ. 0,6994 г Fe и 0,8998 г FeO.
8. Каково содержание хлора в образце, если смешали 2,000 г раствора технического хлорида натрия с избытком раствора нитрата серебра и получили 4,6880 г хлорида серебра?
Ответ. 57,25%.
9. Какова масса серы в 5,6720 г сульфата бария?
Ответ. 0,7790 г.
10. Какова масса каждого из компонентов AgN03, навеска которого 0,7170 г?
Ответ. Ag —0,4553 г; N — 0,0590 г; О-~0,2026 г.
11. Сколько оксида кальция СаО образуется из 0,3672 г хлорида кальция СаС12 . 6Н20?
Ответ. 0,09399 г СаО.
12. Сколько надо взять Fe304, чтобы получить 1,0000 г Fe203?
Ответ. 0,9668 г Fe304.
13. Что такое аналитический множитель? Вычислить аналитические множители в следующих примерах:
определяемое вещество весовая форма
CI AgCl
S BaS04
Fe203 FeP04
14. Каково было содержание Fe304 в магнитном железняке, если 0,5 г образца технического FeSO3 превратили в 0,4110 г Fe203? При вычислении воспользоваться химическим множителем.
15. Сколько чистого серебра нужно растворить в азотной кислоте HNO3, чтобы получить 300,0 г AgNO3?
От в е т. 190,5 г.
16. Кусочек серебряной монеты массой 0,2000 г после растворения дает с избытком хлорида натрия осадок хлорида серебра массой 0,2393 г.:Сколько серебра в монете (в процентах)?
Ответ. 90,10%.
17. Каков состав латуни, содержащей только медь, свинец и цинк, если 0,5 г образца ее дает 0,0023 г сульфата свинца PbS04 и 0,4108 г ZnNH4P04? Сколько (в процентах) может получиться при прокаливании полученной навески фосфата цинка и фосфата аммония?
Ответ. Сu—69,60%; РЬ—0,31%; Zn—30,09% ; 0,3510 г. • -
Дата добавления: 2015-04-15; просмотров: 671; Мы поможем в написании вашей работы!; Нарушение авторских прав |