
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Формулы для вычисления рН растворов сильных кислот и оснований
| Кислота | Основание |

| 
|

| 
|
| В очень разбавленных растворах (при С≤10-2 моль/л) fi ≈ 1 | |
| pH = -lg [H+] | pH = 14 + lg [OH-] |
Пример 4.7.Вычислите активность ионов Н+ и NO 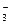 , а также рН 0,3 М раствора HNO3.
, а также рН 0,3 М раствора HNO3.
Решение. Так как концентрация азотной кислоты достаточно велика, рН раствора вычисляем с учетом коэффициента активности f (см. табл. 4.5). Коэффициент активности рассчитываем согласно табл. 4.4 в зависимости от ионной силы раствора τ, которую вычисляем по формуле (4.5).
HN03 = H+ + NO3-; τ = 0,5 (0,3 • 12 + 0,3 • (-1)2) = 0,3
 ;
; 

Активность ионов определяем по формуле (4.13):
[Н+] = [  ] =
] =  =0,3 моль/л
=0,3 моль/л

Согласно табл. 4.5, рН = -lg(0,66• 0,3) = 0,7.
Пример 4.8.Вычислите рН раствора ацетата натрия, если в 250 мл раствора содержится 0,1 г соли.
Решение. В водном растворе ацетата натрия имеет место равновесие:
СН3СОО- + Н2О ↔ СН3СООН + ОН-,
т. е. гидролиз соли по аниону (см. табл. 4.6).  (см. приложение 1).
(см. приложение 1).
Определяют молярную концентрацию раствора CH3COONa: С CH3COONa =ν . 1000/250, ν = 0,1/82 = 0,001 моль — количество вещества, содержащееся в 250 мл раствора (82 — молярная масса СН3COONa). Следовательно, ССНзС00№ =0,001.1000/250 = 0,004 моль/л.
Согласно табл. 4.6, pH = 7 +  4,76 +
4,76 +  lg 0,004 = 8,18.
lg 0,004 = 8,18.
Пример 4.9.Сколько миллилитров 0,1 М раствора NH4Cl надо добавить к 50 мл 0,1 Мраствора аммиака, чтобы получился буферный раствор с рН 9,3?
Решение. Концентрация NH4OH в буферной смеси NH4OH + NH4Cl будет определяться соотношением: N1 • V1 = N2 • V2, следовательно,
СNн4он =0,1-50/(50 + VC), СNH4Cl=0,1.VC/(50 + VC),
где VC — добавленный объем раствора соли NH4Cl (мл).
Учитывая pKNH4OH = 4,76 (см. приложение 1), согласно табл. 4.7, можно записать:
9,3 = 14 - 4,76 + lg (0,1 . 50/0,1 . VC);
lg (50/Vc) = 0,06; 50/VC =100,06;Vc = 43,5 мл.
Пример 4.10.Приготовьте 20 мл буферного раствора с рН 4,0.
Решение. Выбирают уксусную или муравьиную кислоту (так как рКсн3 соон = 4,76, а рКHС00Н = 3,75 , то есть близко к задаваемому значению рН) и соль CH3COONa или HCOONa. Допустим, выбрали СН3СООН и CHaCOONa равных концентраций. В этом случае концентрации компонентов в уравнении табл. 4.7 можно заменить на соответствующие объемы:
 ;
;  ;
;
 ; 100,76=
; 100,76=  ; 5,75=
; 5,75= 
Откуда  =17,04 мл, следовательно,
=17,04 мл, следовательно,  =20-17,04=2,96 мл.
=20-17,04=2,96 мл.
Выполнить задания
1. Вычислите рН следующих растворов:
• 0,4% гидроксида натрия, плотность 1,002 г/см3;
• 0,74% гидроксида калия, плотность 1,004 г/см3;
• 0,1 М азотистой кислоты;
• 0,2 М цианистоводородной кислоты;
• 0,01 М муравьиной кислоты;
• 0,1 М фенола;
• 0,02 М бензойной кислоты;
• 0,1 М гидроксиламина;
• 0,2 М анилина.
2. Вычислите рН среды в 0,1 М растворах следующих протолитов: цианида калия; сульфита натрия; гидросульфита натрия; карбоната натрия; гидрокарбоната натрия; карбоната аммония; фосфата натрия.
3. Вычислите рН среды, если навеску 0,05 г нитрата аммония растворили в 100 мл раствора.
4. Вычислите степень диссоциации в 0,01 М растворах: азотистой кислоты; уксусной кислоты; синильной кислоты; гидроксида аммония; анилина; гидроксиламина.
5. Вычислите кажущуюся степень диссоциации в 0,5 М растворах: а) соляной кислоты при рН 0,37; б) гидроксида калия при рН 13,5.
6. Вычислите концентрацию ионов водорода и гидроксила в растворе, рН которого равен: 2; 9; 6.
7. Вычислите рН смеси, содержащей равные объемы 5% растворов уксусной кислоты и ее натриевой соли.
8. Вычислите рН 0,001 М раствора гидроксида аммония в присутствии 0,1 М раствора хлорида аммония.
9. Вычислите рН 0,01 М раствора иодноватистой кислоты (НIO) в присутствии О,1 М раствора ее соли (NaIO).
10. Вычислите рН смеси аммиака и хлорида аммония, если она приготовлена из 0,1 М растворов этих веществ в отношении 1 : 9.
11. Вычислите рН смеси, если к 200 мл 0,1 М раствора NH40H добавить 2,14 г хлорида аммония.
Дата добавления: 2015-04-15; просмотров: 1371; Мы поможем в написании вашей работы!; Нарушение авторских прав |