
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Антибиотиктер өндірушілердің селекциясы
- антибиотиктер метаболизмі жолдарындағы ферменттер синтезіне жауапты гендердің экспрессиясын күшейту, «жоғарғы өндіруші» алу. Антибиотиктерді өндіретін көптеген белгілі микроорганизмдер химиялық және физикалық мутагендер қолданып, тиімді қоректік орталарды және ферментация жағдайын тандау жасап бір ізді, көп сатылы мутациялар мен селекция арқылы алынған. Табиғи биоценоздардан алынған штамдар антибиотиктерді аз бөледі. Мутагенез көмегімен микроорганизмдердің антибиотик түзетін қабілетін оңдаған және жүздеген рет жоғарлатуға болады.
- антибиотиктердің бүйір топтарының химиялық модификация жолдарымен жартылай синтетикалық пенициллиндер мен цефалоспориндер өндіру. Сонымен қоса, микробты клеткалардың әр нысанасына олардың активтілігі өзгереді;
Ретроспективаға шолу жасасақ, барлық анықталған антибиотиктер 1929 жылдан 1962 жылға дейін селекцияланған екен. Сол жылдардан бастап антибиотикалық активтілігі бар қосылыстардың екі классы ғана ашылған – оксазолидонондар және циклдық липопептидтер. Терапиялық практикада кейінірек шығарылған басқа антибиотиктер – барлардың аналогтары болып келеді. Аналогтар өндірісіне белгілі антибиотиктің табиғи базалық құрылымы алынады, оның модификациясы жасалынады, қорытындысында әсер ету нысанасы өзгерген немесе микробицидті әсері күшейген немесе әсер ету спектрі кеңейтілген және т.б. Қазіргі таңда антибиотик өндірушілер тағайындау үшін белгілі бар препараттардың туындыларын шығару кеңінен таралған. Сонымен қатар, жасанды қосылыстары, бар жаңа антимикробты препараттар, белгілі антибиотиктердің комбинациясын шығару қолға алынды.
- жаңа антибиотиктерді іздестіру, әсіресе молекулалық массасы 30-40 аминқышқылды қалдықтары, Д-аминқышқылы, гетероциклды сақинасы және басқа туындылары бар антимикробты пептидтерді қарастыру;
- микробты клетканың жаңа нысаналарына әсер ететін антибиотикалық дәрілер өндірілуде (дивисомалар, лиганд-рецепторлар, энзимдер немесе клеткаішілік метаболизмнің басқа жолдары және т.б.); нысаналарға олардың әсер етуінің молекулалық механизмдері нақтылануда. Мысалы, жас клеткаларға бөліну процесіне жауапты микробтық клеткалардыңақуыздары ашылды. Бұл дивисома-протеиндері- FtsZ және FtsA және т.б.
Бактериялық клетканың екі жас клеткаға бөліну аймағында нәруыздық құрылым – дивисома (division – бөліну) пайда болады. Әртүрлі бактерияларда дивисома түзілуі ұқсас келеді, басты клеткалары FtsZ және FtsA протеиндері болды. FtsZ протеинніңполимеризация процесі клеткалық бөліну процесін инициирлейді. Микроорганизмдер дақылдарынан және өсімдіктерден алынған 100000 экстрактілерінің кең көлемді масштабты скрининг жасауы FtsZ протеиннің полимеризация және активтену тежеушілерін анықтауға мүмкіндік берді. Нақты айтсақ, Asp.viridinutans зең саңырауқұлақтарынан көптеген грам оң және грам теріс микроорганизмдердің клеткалық бөлінуін тежейтін виридитоксин заты бөлінетіні айқын болды. Виридитоксин эукариотты клеткаларға улы емес.
Жаңа ғылыми зерттеулерді ескере отырып әсер ететін нысаналарды нақтылау: пептидогликан қабаты қалыптасуына гликозилтрансфераза (GT) және транспептидаза (ТР) - екі ферменттің қатысуын талап етеді. Пенициллиндер және басқа бета-лактамды
антибиотиктердің бактерицидтік әсері транспептидазаның тежелуімен іске асады. Екінші нысанасы, гликотрансфераза іске қосылмай қалады. Ғалымдар St. аureus клеткаларынан GT ферментін бөліп алды. Оның құрылысын зерттеуінде екі активті орталығы бар екені анықталды. Алынған қорытындылар негізінде микробты клетканың осы нысанасын тежейтін қосылысты зерттей келе клетка қабырғасы пептидогликанының синтезін тежеу.
- дақылданбайтын микроорганизм геномын – жаңа гендік материал ретінде қолдану. Осындай микроорганизмдердің ДНҚ фрагментін бөліп алып дақылдану штамына енгізеді, осылай алынған рекомбинантты дақылдың микробицидті активтілігі тексеріледі. Егер рекомбинантты штамында микробицидті активтілік пайда болса, антибиотик синтезіне жауап беретін гендер идентификацияланады, олардың экспрессиялайтын активтілігі күшейюі үшін, яғни антибиотикалық заттар өнімі ұлғаю керек;
- микроорганизмдер клеткаларын ыдыратудың табиғи қабілеттілігі бар бактериофагтар гендерін рекомбинантты технологияға қолдану (мысалы, лизин – фагтар түзетін гидролазалық активтілігі бар фермент; грам оңды бактериялардың клетка қабырғасының пептидогликанына адгезия жасап ыдырату барысында клетканы гипотониялық лизиске ұшыратады);
Дегенмен, қазіргі уақытта көптеген жаңа шыққан антибиотиктер – бұл құрылымды аналогтар, белгілі тұқымдастардың туындылары. Бұл жол әзірге жаңа антибактериалық агенттерді өндеудің ең қолайлы өнімді тәсілі болып келеді. Бұрын соң белгілі антибиотикалық заттар компоненттерін бір-бірімен қосу арқылы жаңа комбинирленген препараттар алу (пронтосил – сульфаниламидті препараттардың жетекшісі, метронидазол, изониазид, оксазалидинон). Сонымен қатар комбинациялар бар, антибиотикалық заттар мен энзималар және басқа биологиялы активті қосылыстары микробты клетканың метаболизм процестерін бұзуға қабілетті. Мысалы, комбинирленген бактерицидті препарат – ко-амоксиклав шығарылды (амокcициллин және клавулан қышқылы комплексі).
Микробты клеткаларға антибиотиктердің әсер ету механизмі және антибиотиктерге микроорганизмдердің резистенттілігі
БАКТЕРИЯ КЛЕТКАСЫ
Цитоплазма Сақиналы ДНҚ Клетка мембранасы РНҚ Рибосомалар
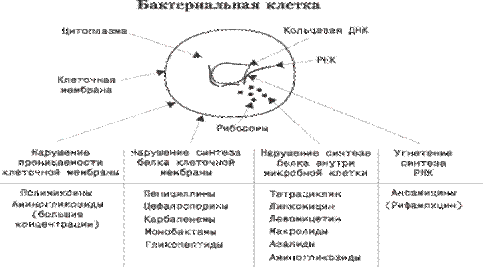
| Клетка мембранасының өткізгіштігі бұзылуы | Клетка мембранасының ақуыздар синтезі бұзылуы | Микробты клетканың ішінде ақуыздар синтезі бұзылуы | РНҚ синтезі тежелуі |
| Полимиксиндер Аминогликозидтер (жоғарғы концентрациясы) | Пенициллиндер Цефалоспориндер Карбапенемдер Монобактамдар гликопептидтер | Тетрациклин Линкомицин Левомицетин Макролидтер Азалидтер аминогликозидтер | Ансамициндер (рифампицин) |
Сурет 51. Антибиотиктердің бактерияға қарсы әсер ету механизмдері
Ескерту. Жүргізілген жеке зерттеулер мәліметтері бойынша көптеген түрлі антибиотиктер бір механизммен жұмыс атқарады, олардың негізінде – нақты жоғары химиялық активтілікке ие ОН гидроксилді радикалдардың пайда болуы, нәтижесінде бактерияның ДНҚ, ақуыздары мен липидтерін зақымдау.
Антибиотиктерге микроорганизмдердің резистентілігі негізінде хромосомалық немесе плазмидалық ДНҚ деңгейінде кездесетін мутациялар жатыр, келесі төзімділік механизмдерін қалыптастыруға әкеледі:
- микробты ферменттер антибиотиктерді гидролиздейді немесе антибиотиктер байланыстыратын нәруыздарсинтездеуі. Ең алдымен бұл бета-лактамазалар (осы топтың 200 астам ферменттері анықталды), 4 молекулалы кластарға жатады (А, В, С және Д). А, С және Д кластағы бета-лактамазалар серин типті ферменттерге жатады (олардың активті орталықтарында серин аминқышқылы бар), олар пенициллиннің бета-лактамды сақинаның бір байланысын гидролиздейді. Сонымен қатар, грам оң және грам теріс бактерияларда макролидтер мен линкозамидтерді инактивациялайтын фермент кездеседі (E.coli, St. аureus және т.б. - макролидфосфотрансфераза, энтеробактерияларда - эритромицинэстераза, стафилококтар мен энтерококктарда – линкомицинацетилтрансфераза). Алтын түсті стафилококкта ПСБ 2а пенициллин байланыстыратын нәруыз синтезіне қабілетті мутацияның бір нұсқасы анықталған, нәтижесінде осындай штамды микроорганизмдер барлық беталактамды антибиотиктерге төзімділік тудырады;
Бета-лактамды антибиотиктерге микроорганизмдердің кең таралған төзімділік механизмдерінің бірі олардың ферменттік инактивациясы, бета-лактамаза ферменттерінің бета-лактамды сақинасының бір байланысы гидролизге ұшырауынан болады. Сонымен қатар резистенттілік қалыптасуының басқа механизмдері де белгілі: антибиотикке клетка мембранасы өткізгіштігін төмендетуі, соңғының микробтық клеткадан жылдам шығып кетуі (әсіресе грам теріс бактерияларда), әсер ету нысанасын модификациялау, пептидогликан синтезіне қатысатын нәруыздардың беталактамдарға туыстығын әлсіретуі;
- клетка ішілік кеңістікке антибиотикалық заттар түсетін саңылаулар, каналдар диаметрін және саның азайтуынан туындаған антибиотиктердің микробтық клеткаға клеткалық және цитоплазматикалық мембрана арқылы түсу жолдарын шектеу (саңылаулар пенициллин байланыстыратын ақуыздардыжауып тұратын сыртқы фосфолипидті мембранада орналасады). Микроорганизмдерде сырттан антибиотикалық қосылыстар түсуіне арналған каналдардың қалыптасуына жауапты OmpF және OmpC саңылаулы ақуыздар синтездеу қабілетін жою;
- антибиотиктерге бактериялардың төзімділігіне әкелетін келесі механизмі «помпа» механизмі деп аталатын, олардың микробтық клеткадан қарқынды түрде шығып кетуі («помпа» – ксенобиотиктерді, соның ішінде антибиотиктерді де байланыстыратын және клеткадан шағаратын ақуыздар; периплазматикалық кеңістікке ксенобиотиктерді тасымалдайтын ақуыздар; антибиотиктерді шығаруға арналған каналдар, саңылаулар түзетін ақуыздар; периплазматикалық кеңістікте орналасқан линкер-ақуыздары және канал түзетін ақуыздардың транспортер ақуыздармен байланыстыру). Бір «помпа» (мысалы, P.аeruginosa-да) антибиотикалық әсер ету механизмі, құрылысы бойынша бірнеше әртүрлі препараттарды клеткадан шығара алады. Тетрациклинге төзімділік механизмі қарқынды шығару процесімен атқарылады. Резистентілік детерминанталар плазмидаларда орналасқан, сондықтан осындай антибиотиктерге жылдам түр аралық және түрішінде төзімділік таралуын қамтамасыз етіледі;
- антибиотик әсер ететін микробтық клетканың нысанасын модификациялау. Мысалы, хинолондар мен фторхинолондар өздерінің антимикробтық әсерін ДНҚ-гираза және топизомераза IV - бактериялық ферменттер арқылы іске асырады. Осы ферменттердің, микробтық клетканың осындай нысаналарының инактивациясы бактериялық ДНҚ репликациясын бұзады. Спонтанды мутациялар микроорганизмдердің рибосомалық РНҚ 23S- және 50S-суббірлікті кодтайтын гендерді активтенуімен сипатталады. Сондықтан антибиотиктер рибосомамен байланысу қабілетінен айырылады және ДНҚ-гираза мен топоизомераза ІV ақуыз-ферменттердің синтезін бұзады. Аминогликозидтерге төзімділіктің негізгі механизмі бұл микроорганизмдердің ферменттік модификациясына негізделген. Аминогликозидтердің модификацияланған молекулалары микробтық клеткада рибосомалармен байланысу қабілетінен айырылады жәнепротеиндербиосинтезін басып тастайды. Фторхинолондарға төзімділігінің басты механизмі – екі бактериялық ферменттердің - ДНҚ-гираза және топоизомераза ІV нысаналарына модификация жасалуынан қалыпты репликациясына қажетті бактериялық ДНҚ молекуласындағы конформациялық өзгерістер байқалады. Макролидтер, кетолидтер және линкозамидтердің әсер ету нысана модификациясы ретінде бактериялық рибосоманың 50S суббірлігі болады.
Антибиотиктерге төзімліліктің тағы бір механизмі - бұл метаболизмдік «шунттың» қалыптасуы.
Дата добавления: 2015-04-16; просмотров: 346; Мы поможем в написании вашей работы!; Нарушение авторских прав |