
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Медицинада ферменттердің қолданылуы
Медициналық энзимология инженерлік энзимологияның жеке құрамды бөлігі болып табылады және медициналық практикада қолданылуына байланысты 3 негізгі бағытта дамиды (кесте 12).
Кесте 12.Медицинада ферменттердің қолданылуы
| Тағайындалуы | Ферменттер | Қолданылуы |
| Диагностика | Лактатдегидрогеназа (изоферментЛДГ-1) | Миокард инфарктысы |
| Аспартатаминотрансфераза (ACT) | Миокард инфарктысы | |
| Аланинаминотрансфераза (АЛТ) | Инфекциялық гепатит, миокард инфарктысы | |
| Креатинфосфокиназа (КФК) | Үдемелі дистрофия, миокард инфарктысы | |
| Қышқыл фосфатаза (КФ) | Қуық асты безінің обыры | |
| а-Амилаза | Ұйқы безі аурулары | |
| Терапия | Пепсин | Асқазанда ақуыз қорытылуының бұзылуы |
| Трипсин, химотрипсин | Іріңді жараларды емдеу | |
| Стрептокиназа, урокиназа | Тромб түзілуіне қарсы | |
| Гиалуронидаза | Тыртықтың түзілуіне қарсы | |
| Аспарагиназа | Кейбір қатерлі ісіктерді емдеу | |
| Нуклеаза (ДНКаза) | Вирусты конъюнктивит, ринит, іріңді бронхит | |
| Уреаза | Организмнен «жасанды бүйрек» аппараты көмегімен мочевинаны шығару | |
| Аналитикалық реактивтер ретінде | Глюкозооксидаза | Қандағы глюкоза концентрациясын анықтау |
| Холестеролоксидаза | Қандағы холестерин концентрациясын анықтау | |
| Липаза | Қандағы триацилглицеринді анықтау | |
| Уреаза | Қандағы мочевина концентрациясын анықтау |
Энзимопатология
Энзимопатология (ферменттердің жетіспеушілігінен немесе болмауымен сипатталатын аурулар); ферменттердің синтезін немесе активтілігін реттеу механизмдерінің бұзылуына негізделген патологиялық процестің молекулярлық даму негіздерін зерттейді.
Ферменттер катализаторлық қызмет атқарумен қатар, айқын органотропты және жоғары талғамды қасиеттері болғандықтан, патологиялық процестерге бағытталған нәзік және әрі талғамды құрал ретінде қолданылады.
Ферменттер жалпы каталитикалық функциясын ғана атқарып қоймай, сонымен қатар айқын мүшелік троптылыққа және жоғары спецификалық әсерге ие бола тұрып, патологиялық процеске бағытталған әсер ету мақсатында таңдамалы құрал ретінде қолдануға болады. (Одно из двух предложений)
Қазіргі кезде 2000 – нан астам адамның тұқымқуалайтын ауруларының 20-30-ң ғана дамуының молекулярлық механизмдері зерттелген. Көбінесе ауру ағзада бір ғана фермент синтезінің тұқымқуалаушы жетіспеушілігі немесе толық болмауынан дамиды.
Мысал ретінде бауырдағы спецификалық ферменттің синтезделмеуінің әсерінен дамитын фенилпирожүзімдік олигофрения – ерте жаста өлімге немесе ауыр ақыл-есінің артта қалуына алып келетін тұқым қуалаған ауру.
Аурудың молекулалық дефектісі фенилаланиннің (Фен) ауыстыруға болмайтын аминқышқылын тирозинге (Тир) айналдыруына тосқауыл қоюына негізделген. Себебі бұл реакцияны катализдейтін, қалыпты жағдайда тек бауыр клеткаларынан анықталған фен-4-монооксигеназа ферменті синтезделмейді.
Фенилаланин алмасуының бұзылуы нәтижесінде ағзада фенилаланиннің және фенилаланин алмасу қалдықтарының ( фенилпирожүзім қышқылы ) организмде, әсіресе ми тіндерінде, қан сарысуында жиналуына алып келеді. Фенилаланинді немесе фенилпирожүзім қышқылын химиялық жолмен анықтау негізінде диагноз қойылады. Емі баланың қоректену рационынан ана сутінен фенилаланинді алып тастауға негізделген. Ал тирозин балаларға маңызды амин қышқылы болып табылады.
Тұқымқуалаушы аурудың басқа бір турі – галактоземияның даму негізіне бауыр клеткаларында галактозаның глюкозаға айналуын катализдейтін фермент синтезделмеуі болып табылады. Нәтижесінде ағзада галактозаның жиналуынан нәрестелерде катарактаның дамуы, бауыр және ми тіндерінің зақымдалуы дамиды. Емі - рационнан сүт қантын алып тастауға негізделген.
Тұқымқуалаушы аурулардан басқа, энзимопатология әртүрлі соматикалық аурулардың, қатерлі ісіктердің, артериосклероздың және ревматоидты артриттің даму механизмдерін зерттейді. Синтезделуі немесе реттелуінің бұзылуы нәтижесінде патологиялық процеске алып келетінін ескере отырып ферменттік жүйелердің және жеке ферменттердің маңызы зор екендігін түсіну киын емес.
Энзимодиагностика
Ағзадағы әрбір тінге сандық және сапалық жағынан әртүрлі ферменттер және изоферменттер тобы тән. Осы ферменттердің ағзада жетіспеуінен түрлі аурулар дамиды.Ферменттік диагностика аурудың диагнозын ғана емес, сонымен қатар жүргізіліп жатқан ем эффективтілігін анықтау үшін маңызды. Сонымен қатар энзимодиагностика - қан сарысуындағы, асқазан сөліндегі, зәрдегі, жұлын сұйықтығындағы ферменттер концентрациясын анықтауға негізделген биотесттер жасауда маңызы зор.
Мысалы, жүрек жетіспеушілігі, жүректің ишемиялық ауруы кезінде қан сарысуында трансаминазалар (аспартатаминотрансфераза и аланинаминотрансфераза) активтілігі сәл жоғары болса, ал миокард инфарктысы кезінде 20 мин кейін трансаминазалар активтілігі 10-100 есе көбееді. Сонымен қатар қан сарысуындағы трансаминазадан басқа, миокард инфарктысын дәлелдейтін информативті әдіске лактатдегидрогеназды және креатинфосфокиназды тесттер жатады. Миокард инфарктысы кезіндегі жүрек бұлшықетінің некрозы нәтижесінде қанға ыдырау өнімдері мен ферменттер бөлінеді. Инфакт жағымды аяқталған жағдайда қан сарысуындағы ферменттер деңгейі 2-3 күні қалыпқа келеді. Қайталамалы миокард инфактысы болған жағдайда (көбінесе аурудың бірінші аптасында дамиды) электрокардиаграммада ешқандай өзгерістер болмауы мүмкін, бірақ ферменттік тесттер қан сарысуындағы ферменттердің жедел өсуімен көрінеді.
Клиникалық практикаға изоферменттерді анықтау әдістерін ендіргеннен кейін ферменттердің диагностикалық маңызы өсті.
Лактатдегидрогеназа (ЛДГ) – кең таралған фермент, ағзаның барлық дерлік клеткаларында синтезделеді, ЛДГ-нің 1-, 2-, 3-, 4- и 5-ші изоферменттері бар.
Жүрек бұлшықетінің органикалық зақымдалуы кезінде, мысалға миокард инфарктысында қан сарысуында жалпы лактатдегидрогеназа жоғарлап, қана қоймайды. Нақты диагноз кою үшін манызы бар ЛДГ 1 және 2 изоферменттерінің қан сарысуында қүкт көтерілуі байқалады.
Бауырдың қабынулық аурулары кезінде изоферментті спектр солдан оңға ығысады (яғни, 5 және 4 изоферменттер 1 және 2 изоферменттерге қарағанда жедел жоғарылайды). Журек патологиясында макроэргиялық субстраттың негізгі фермент креатинфосфо-киназаның 3 изоферменттің түрінің де белсенділігі өзгереді.

Сурет 46. Инфаркттан кейін қан ферменттер активтілігінің өзгеруі
Ординат өсі бойынша – активтілік жоғарлауының қалдықсыз бөлінгіштік еселігі. 1 – КК; 2 – ЛДГ; 3 – бета-гидроксибутиратдегидрогеназа. Инфарктан кейнгі күндер
Диагностикалық энзимология тек аталған мүшелердің ауруларын анықтауда ғана емес, сонымен қатар бүйрек, ұйқы безі, асқазан, ішек және өкпе ауруларын анықтауда үлкен жетістіктерге жетті.
Мысалға, клиникалық практикада бүйрек және ұйқы безінде түзілетін қан сарысуында кездесетін трансамидиназа ферментін анықтау; немесе тек қана бауыр клеткаларында және тері эпидермисінде кездесетін гистидаза ферментінің активтілігін анықтау. Аталған ағзалардың зақымдалуы кезінде, қабыну үрдісінде, жарақат алғанда, хирургиялық әрекеттер кезінде қан сарысуында қалыпты жағдайда байқалмайтын, бұл ферменттердің белсенділігі артады.
Энзимотерапия
Бұл тұқымқуалаушы, соматикалық және жұқпалы аурулар кезінде ағзаға жетіспейтін ферменттерді енгізу немесе мүшелер мен тіндердің функциясын ферменттер комплексімен қалыпқа келтіру (сур.47).
Медициналық практикада ферменттер көбінесе жергілікті іріңді-некроздік процестер кезінде (трипсин, химотрипсин, рибонуклеаза және басқалар), тыртықтардың сіңуі (гиалуронидаза), пероральды ас қорыту процестерін жақсарту үшін (пепсин, химотрипсин, панкреатин, комплексті препараттар - фестал, дигестал және басқалар), тромбоздар кезінде фибринолиздік әсері бар ферменттік препараттар (фибринолизин, стрептокиназа, урокиназа және басқалар).
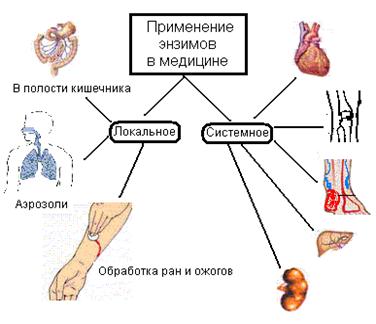
Әнзимдерді медицинада қолдану Ішек қуысында Жергілікті Жүйелі Аэрозольдер Күйіктермен жараларды тазарту
Сурет 47. Медицинада ферменттік препараттардың терапиялық қолданылуы.
Мысалға, трипсин және химотрипсин пептидті байланыстарды гидролиздейді (трипсин лизин+аргинин байланысын ыдыратады, ал химотрипсин гидрофобты амин қышқылдарынаң туратын пептидті байланысуға әсер етеді), (Кесте 13).
Кесте 13. Гидролитикалық ферменттердің (трипсин, химотрипсин) әсер ету спектрі
| Фермент | Ісінудің төмендеуі | Тромболиз | Фибри-нолиз | ЦИК ыдырауы | Рецепторлар модуляциясы | Клеткалық активтілік |
| Трипсин | + + | + + | + + + | - | + + | + |
| Химотрипсин | - | + | + + + | + + | + + | + |
Ферменттерді ағзада олардың жетіспеушілігі (туа п.б., жүре п.б.) кезінде, зат алмасудың кейбір өнімдерін (мысалы, мочевина) спецификалық ыдырату мақсатында қолданылады.
Қазіргі кезде медицинада жүйелі энзимотерапия кеңінен қолданылады – бұл ем әдісі алдын-ала құрылған протеолиттік ферменттер қоспасының бүкіл организмге кешенді әсеріне негізделген.
Вобэнзим және Флогэнзим сияқты препараттар құрамында өсімдік және жануар табиғатты протеолиттік ферменттер – панкреатин, бромелаин, трипсин, пепсин, химотрипсин, липаза, амилаза, протеаза, сонымен қатар лактаза, мальтаза, сахараза, бифидобактериялар, пурпур эхинацеясы, супероксиддисмутаза, цинк цитраты, Барлей шөбінің шырыны, хлореллалар бар. Булардың әркайсысының дозасы арнайы іріктеп алынған.
Ферменттін комплексті препараты асқорыту ферменттері мен дәрілік өсімдіктерден тұрады. Құрамына кіретін дәрілік өсімдіктер: солодка – Licorice extract, құрамында гликозидтер, флавоноидтар, сапониндер; артишок – Cynara scolymus, құрамында фенол қосындылары, С, В топ витаминдері, каротиноидтар, микроэлементтер (марганец, фосфор,темір), детоксикациялық және өт айдағыш әсері бар, холестерин алмасуын жақсартады; куркула – Turmetis extract, антиоксидантты, антисептикалық, ауруды сездірмейтін, өт айдағыш және иммуномодуляциялық әсері бар.
Асқорыту ферменттерінің құрамына панкреатин, липаза, бромелаин, папаин, амилаза, амилогликозидаза, протеаза, целлюлаза, лактаза, гемицеллюлаза кіреді.
Комплекстік ферменттік препараттар құрамына кіретін бромелаин және папаин келесі қасиеттерге ие (кесте 14). Бромелаин – жоғары молекулалы гликопептид, белоктарды поли- және олигопептидтерге дейін ыдыратады, рН 3,0-8,0 биологиялық активтілігін сақтап қалады; қабынуға қарсы және иммуномодуляциялық әсері бар. Папаин – монотиолды цистеинді эндопротеаза, рН 3- 12 кезінде активті, ақуыздары полипептидтер мен амин қышқылдарына дейін ыдыратады, фибринолиттік әсері бар; папайя ағашынан алынады.
Кесте 14. Гидролитикалық ферменттердің (бромелаин и папаин) әсер ету спектрі
| Фермент | Ісінудің төмендеуі | Тромболиз | Фибри-нолиз | АИК ыдыратуы | Рецепторлар модуляциясы | Клеткалық белсенділік |
| Бромелаин | + + + | + | + + | + + | + | + |
| Папаин | + | + + | - | + + + | + + | + |
Аналитикалық реактивтері ретінде
Биосенсорлы құралдар құрамында биоселективті материал ретінде глюкозооксидаза (қандағы глюкоза концентрациясын анықтау), холестеролоксидаза (қандағы холестерин), липаза (қандағы триацилглице-ридтер), уреаза (қандағы мочевина концентрациясын анықтау)
Қан сарысуындағы глюкоза концентрациясын анықтау үшін 2 фермент қолданылады – глюкозооксидаза және пероксидаза: глюкоза глюкозооксидазаның әсерінен глюконат және сутегі пероксидіне эквимолярлы мөлшерде тотығады. Сутегі пероксиді пероксидаза жылдамдататын тотығу конденсация реакциясы арқылы оңай анықталады. Глюкозооксидаза және пероксидаза әсері нәтижесінде 2 боялмаған субстраттар - фенолдың хлорлы туындылары, 4-аминофеназон - боялған өнімге айналады, олардың концентрациясын фотоэлектрокалориметрмен анықтайды.
Ферменттерді қолданудың перспективті бағыттары
1) Адамның лимфоретикулосаркомасы және жедел лимфобластты лейкоз емінде микробтық фермент L-аспарагиназаның қолданылуы сыналды. Бұл ферментті алу технологиясында E.сoli, Serratia marcescens, Erwinia caravotora-ның мутантты штамдары қолданылады. Сонымен қатар Er. сaravotorа–дан алынған L-аспарагиназа ферментінің суперэкспрессивті генін геномына трансфицирленген E.coli рекомбинантты штамы алынды.
L-аспарагиназа 1904 ж. жануар тінінде, кейін өсімдіктерде табылған. Фермент нәтижесінде аспарагин қышқылы және аммиак түзілетін аспарагиннің гидролизін катализдейді, азот және сутегі алмасуындағы маңызды фермент болып табылады. 1953 ж. зерттеу бойынша теңіз шошқасының қанында жоғары мөлшерде кездесетін L-аспарагиназа ферментінің әсерінен тышқандарда экспериментальды лейкоз тежелді. Ісікке қарсы әсер механизмі тіндерде L-аспарагин концентрациясының төмендеуіне негізделген, нәтижесінде ісіктік клеткаларда ақуыз синтезі төмендейді, ол болса ісіктің басылуына алып келеді. L-аспарагиназаның барлық түрі ісікке қарсы әсерге ие емес. E.coli, Erwinia carotovora, Erwinia chrysanthemi, Psеudomonas fluorescens – тің L-аспарагиназа ферментінің ісікке қарсы әсері айқын. Ал Pseudomonas geniculata, Saccharomyces cerevisiae-дағыбұл фермент ісікке әсер етпейді. Нативті микробты аспарагиназа анафилактикалық шокқа алып келетін аллергиялық реакциялар шақыруы мүмкін. Сондықтан аспарагиназаның антигенді детерминантасын эпитопты картасын жасаған кейін ферменттің антигендік активтілігі 8 есе төмендеген модифицирленген, рекомбинантты формалары алынды.
L-аспарагиназаны алу және тазарту технологиясы: балластты ақуыздарды жою (термоөңдеу, органикалық еріткіштермен және аммоний сульфатымен макромолекулаларды фракциялау):
1) 2 этапты хроматографяии; метанолмен фракциялау, этанолмен кристалды ферментті тұндыру, сефароза сорбентін қолдану арқылы аффинді хроматография. ПЭГ, альбумин, полисахаридтерде иммобилизденген аспарагиназа препараттары алынған, препараттың липосомалы формасын алу және ферментті нанобөлшектерге инкапсульдеу технологиялары өндірілуде;
2) Қант диабеті патогенезінде клеткалардың инсулинге сезімталдығының болмауының дамуында диацилглицеролкиназа-дельта (ДГК-дельта) ферментінің маңызы зор. ДГК-дельта жеткіліксіздігі кезінде клетка инсулинге әлсіз жауап әсерінен клеткада глюкоза, липид алмасу бұзылады. Бұл фермент глюкозаға тәуелді болып келеді, яғни қанда глюкоза көбейген сайын фермент түзілуі төмендейді;
3) АВО жүйесінің эритроцитарлы антигендерін ыдырататын ферменттер бөліп алынған. Ферментпен II–IV қан тобын өңдегенде А және В антигендері жойылады, нәтижесінде бұл қанды барлық науқастарға құюға болады. АВО жүйесі бойынша қан топтары эритроциттерде осы антигендердің болуымен ерекшеленеді. I қан тобында ешқандай антигендер жоқ, сондықтан бұл топты барлық донорларға құюға болады.
Elizabethkingia meningosеpticum бактериясы А антигенін, ал Bacteroides fragilis – В антигенін жақсы ыдырататын болып шықты. Осылайша микроорганизмдер ферментін қолдана отырып құрамында АВО жүйесі антигендері жоқ донорлық қанды өндірістік масштабта өндіру мүмкіндігі болып отыр. Бірақ бұл әдісті қазіргі уақытта тек резус-теріс қанмен жүргізуге болады.
8. АНТИБИОТИКТЕР 
8.1. Антибиотиктер сипаттамасы
1907 жылы П. Эрлихке (химиотерапия негізін қалаушы) 606 экспериментте мерезді сауықтыратын қосылысты тапты (арсфенамин, №606 зат); 1932 жылы Домагк сульфаниламидті ашады; 1928 жылы А. Флеминг – пенициллинді; 1943 жылы З. Ваксман - стрептомицинді.
Антибиотиктер биотехнология мен медицина тарихында ерекше орын алады. Е. Хаувинк (1984) жылы биотехнология дамуының бір кезеңін антибиотиктер дәуірі деп атады. Сөз жоқ, бұл орынды, себебі вакциналармен бірге антибиотиктер бұрын соң мыңдаған, миллиондаған адам өмірін алып кеткен, мемлекеттер өміріне әлеуметтік және экономикалық хаос тудырған адамзаттың көптеген қаумақты инфекцияларына тосқауыл қойды. Қазіргі уақытта антибиотиктің маңызы басым, қолданылып жатқан емдік-профилактикалық дәрілер арасында 13% құрайды.
«Антибиотик» терминін (anti – қарсы, bios – өмір) З. Ваксман ұсынды. Антибиотиктер – бұл қарқынды антимикробты активтілігі бар тәбиғи немесе жасанды заттар. Оларды микробтық клеткалардан, өсімдіктерден және жануар тінінен алынады; химиялық жолмен синтезделеді.
Микроорганизмдердің антибиотиктері, пигментер, токсиндер секілді екіншілік метаболиттер. Олардың биологиялық қасиеті тіршілік ортасында микроорганизмдердің басқа топтар тіршілігін тежеу арқылы конкурентті түрде өмір сұруі.
Антибиотиктер – бұл төменгі молекулалы заттар, массасы шамамен 1000 дальтон, тікелей емес трансляция өнімі, күрделі биосинтез жолымен сипатталынады.
Оларды микробтық клеткада полимеризация реакция қорытындысы бойынша ароматты қосылыстардан, аминқышқылдардан және басқа біріншілік метаболиттерден синтезделінеді. Антибиотиктердің синтезі белгілі деңгейде ароматты аминқышқылдар синтезінің метаболизм жолдарына ұқсас (тирозин-хлорамфеникол); көмірсу текті антибиотиктердің түзілуі грам теріс микроорганизмдердің клетка қабырғасы полисахаридтер синтезі жолдарына ұқсас. Аминқышқылдары, моноқанттар, ацетат-малонатты бірліктердің полимеризациясынан басқа антибиотиктерді микробты клеткалардың біріншілік метаболиттер модификация немесе бірнеше модификацияланған біріншілік метаболиттердің конденсациясымен синтезделуі жүреді. Нуклеозидті табиғаты бар кейбір антибиотиктер пуринді немесе пиримидинді нуклеозидтер синтезінің метаболизм жолдарына ұқсас түзіледі.
Антибиотиктер синтезі көп сатылы метаболизм жолынан өткендіктен оған оңдаған және одан да көп ферменттер қатысады, сондықтан жоғары өндіруші алуында ұзақ мутагенез бен селекция жүреді. Сонымен қатар, антибиотиктер негізгі алмасу метаболиттерге жатпайды, клеткалар оларсыз да тіршілігін сақтайды.
Антибиотиктер өндіруші қатарына негізінен сапрофитті, гетеротрофты, жиі топырақ микроорганизмдері кіреді – бактериялар, актиномицеттер, мицеллалы саңырауқұлақтар; сонымен қатар, медицинада кеңінен жасанды және жартылай синтетикалы антибиотиктер және өсімдіктер мен жануарлар текті антибиотиктер кездеседі.
Бір түр микроорганизмдері әртүрлі табиғатты антибиотиктер синтездей алады, және керісінше, бір антибиотикті түрлі таксономиялық топтағы микроорганизмдер өндіре алады.
9000 антибиотик белгілі, ал медициналық мақсатта тек 200 қосылыстары қолданылады. Солардың ішінде пенициллин, цефалоспориннің жартылай синтетикалық туындылары, жасанды препараттардан - фторхинолондар өндірісі басым доминантада. Жалпы алғанда, антибиотиктер фармацевтикалық индустрияда маңызды орын алады (сур. 48).

Сурет 48. 2005-2010 жылдары дүние жүзінде антимикробты препараттарды сату болжамы (млрд. долл.). Ақпарат көзі – Arrjwhead Publishers есебі, 2007 жылдың тамыз айы.
Басқа биологиялық активті заттардан антибиотиктер антимикробты әсерімен және микроорганизмдердің нақты түріне іріктеп әсер көрсетуімен ерекшелінеді, яғни әр антибиотиктің спецификалық антимикробты әсер ету спектрі бар. Медицинада қолданылатын антибиотиктерді ветеринарияда, ауыл шаруашылықта қолданылмайды, және керісінше.
Өзекті мәселелері бар – бұл антибиотиктерге микроорганизмдердің полирезистенттілігі. Жыл сайын осындай полирезистентті штамдар 2 млн аурулардың себепшісі болып келеді (алтын түсті стафилококк, нәжістік энтерококк, гемолитикалық стрептококк және т.б.). Микроорганизмдер қолданыстағы антибиотиктер кластарына төзімді болып келеді, уақыт өте келе жаңадан өндірілген антибиотикке микробтық клеткаларда потенциалды молекулалық нысаналардың жеткіліксіздігі байқалады.
Көптеген фармацевтикалық компаниялар жаңа антибиотиктер өндіруіне қызығушылық танытпайды – оған ұзақ уақыт қажет (ен кемінде 5-7 жыл), жүздеген миллион доллар қаражат кетеді және дәрі сатылып кетуіне үлкен қауіпі бар. 1970-80 жылдары көптеген транснационалды компаниялар (АҚШ, Еуропа және т.б.) лицензиялық жағдайда антибиотиктер субстанцияларының көптоннажды өндірісін Үндістанда, Қытайда және басқа елдерде ұйымдастырған. Қазіргі уақытта барлық антибиотиктер субстанциясының 80% Еуропаға Үндістан және Қытайдан жеткізіледі. Мысалы, дүние жүзі саудасында Қытайдың үлесі – пенициллин субстанциясы бойынша 70% құрайды, аспирин - 50%, парацетамол - 35%, және бағалары еуропалықтармен салыстырғанда 35-60% төмен. Антибиотиктердің заманауи өндірісіндегі ерен алып баратқан тенденция - бұл дженериктерді шығару, патентті қорғаныс мерзімі өтіп кеткен препараттар өндіру немесе белгілі антибиотиктердің модификацияланған туындылар өндірісін қолға алу.
Дата добавления: 2015-04-16; просмотров: 595; Мы поможем в написании вашей работы!; Нарушение авторских прав |