
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Изотермы адсорбции. Как показали исследования, адсорбция увеличивается с ростом давления (концентрации) газа, однако это увеличение не беспредельно
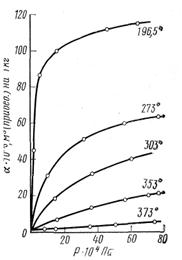 Как показали исследования, адсорбция увеличивается с ростом давления (концентрации) газа, однако это увеличение не беспредельно. Для каждого адсорбируемого газа (при t = const) через некоторое время над адсорбентом устанавливается предельная величина адсорбции, отвечающая равновесию между обеими фазами. Кривая зависимости адсорбции от давления (концентрации) при постоянной температуре носит название изотермы адсорбции. Она является одной из важнейших характеристик адсорбционных процессов. На рис. 5.2 изображены типичные изотермы адсорбции СО2 углем при различных температурах, взятые из работы А. А. Титова. Рис 5.2
Как показали исследования, адсорбция увеличивается с ростом давления (концентрации) газа, однако это увеличение не беспредельно. Для каждого адсорбируемого газа (при t = const) через некоторое время над адсорбентом устанавливается предельная величина адсорбции, отвечающая равновесию между обеими фазами. Кривая зависимости адсорбции от давления (концентрации) при постоянной температуре носит название изотермы адсорбции. Она является одной из важнейших характеристик адсорбционных процессов. На рис. 5.2 изображены типичные изотермы адсорбции СО2 углем при различных температурах, взятые из работы А. А. Титова. Рис 5.2
Как видно из рис. 1.2, повышение давления газа увеличивает адсорбируемое количество его. Однако на разных участках изотермы адсорбции это влияние сказывается неодинаково. Наиболее сильным оно оказывается в области низких давлений, где адсорбция подчиняется закону Генри для растворимости газов в жидкостях, т. е. она прямо пропорциональна давлению газа.
Дальнейшее повышение давления тоже увеличивает количество адсорбированного газа, но уже во все уменьшающейся степени. И, наконец, при достаточно высоких давлениях кривая стремится к прямой, параллельной оси абсцисс. В этом случае достигнуто полное насыщение адсорбента и повышение давления газа уже не влияет на его адсорбцию.
Таким образом, между адсорбцией и давлением (концентрацией) газа отсутствует прямая пропорциональная зависимость. Это и вызвало необходимость найти математическое выражение, которое достаточно точно описало бы экспериментальные данные. Впервые эмпирическое уравнение, которым пользуются и в настоящее время, было предложено Фрейндлихом. Это уравнение имеет следующий вид:

| 5.3 |
где х/m— величина адсорбции на единицу массы адсорбента; р — равновесное давление газа над поглотителем (для растворов пользуются равновесной концентрацией С), К и 1/n — константы адсорбции, характерные для данного процесса адсорбции в определенных пределах, значение которых можно найти из опытных данных.
Рассмотрим, как определяются численные значения констант. На рис. 5.3, а дано графическое изображение уравнения для случая адсорбции из жидкости. По оси абсцисс отложены равновесные концентрации С (кмоль/м3), по оси ординат — значения х/m
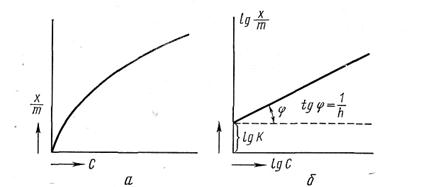
Рис 5.3
(кмоль/кг). Если прологарифмировать уравнение (5.3), получим следующее выражение:
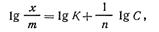
| 5.4 |
из которого можно найти значения постоянных К 1/п. Для этой цели построим график, выражающий зависимость lg х/m — lg С. Получается прямая линия (рис. 5.3 ,б), отсекающая на оси ординат отрезок, равный lg К, а тангенс угла наклона этой прямой к абсциссе дает значение 1/n.
Уравнение (5.4) есть уравнение прямой линии. Несмотря на то, что уравнение Фрейндлиха широко применяется на практике, оно имеет определенные недостатки. Многочисленные исследования показали, что значение адсорбции, вычисляемое на основании этого уравнения, не соответствует данным опыта в области малых и больших концентраций. Константы К и 1/n являются чисто эмпирическими и не имеют реального физического смысла.
Позднее (1917) Ленгмюр вывел простейшее уравнение адсорбции для случая адсорбции газа на гладкой твердой поверхности (стекло, слюда, монокристаллы), оказавшееся в дальнейшем применимым и к другим поверхностям раздела. При выводе своего уравнения Ленгмюр исходил из допущения, что адсорбционный слой мономолекулярен, т. е. только один слой молекул связан силами молекулярного сцепления с поверхностью. При этом указанный слой полностью поглощает собой все адсорбционные силы поверхности адсорбента, поэтому образование второго слоя адсорбированных молекул исключается.
Число активных мест поверхности ученый принял равным единице, а долю активных мест, связанных с адсорбированными молекулами, обозначил через х. При этом условии свободная часть поверхности равняется 1—х. Обозначив величину адсорбции через Г и учитывая, что при х=0, Г = 0 и при х=1, Г = Г∞, он нашел, что х=Г/Г∞, где Г — количество вещества, адсорбированное единицей поверхности при полном насыщении.
Тогда уравнение Ленгмюра можно записать:
Г = Г∞ 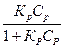
| 5.5 |
Опыт показывает, что уравнение изотермы адсорбции Ленгмюра сравнительно удовлетворительно дает количественную характеристику адсорбции при низких и при высоких концентрациях поглощаемого вещества. В отличие от уравнения изотермы Фрейндлиха все величины, входящие в уравнение Ленгмюра, имеют определенный физический смысл и вполне обоснованы теоретически. Уравнение Ленгмюра исходит из расчета мономолекулярного адсорбционного слоя.
Однако не все ученые разделяют эту точку зрения. По мнению Поляни и ряда других авторов, возможен многослойный адсорбционный слой, причем эта точка зрения имеет некоторое теоретическое и опытное обоснование.
По теории Ленгмюра молекулы адсорбтива, притянутые к отдельным активным точкам, между собой не взаимодействуют. Однако при накоплении в адсорбционном слое молекул веществ, обладающих высокой молекулярной массой, между ними могут возникнуть значительные силы сцепления. В этом случае уравнение Ленгмюра дает неверные результаты. В ряде случаев, в частности при применении пористых адсорбентов, таких, как уголь, силикагель и др., формула Фрейндлиха дает лучшие результаты, чем уравнение Ленгмюра.
Изотерма Брунауэра – Эммета – Теллера (БЭТ) см. рис.5.4.
Теория адсорбции БЭТ исходит из:
1) адсорбционный слой имеет непостоянную толщину на поверхности адсорбента;
2) тепловой эффект адсорбции ≠ тепловому эффекту конденсации адсорбтива;
3) центры адсорбции – двумерные ячейки на поверхности адсорбента;
4) латеральное взаимодействие отсутствует.
Уравнение БЭТ – изотермы:
P/ V(P0–P) = 1/ Vм∙S + (S–1)/Vм∙S ∙ P/P0
P0 – давление насыщенного пара адсорбтива;
V – объем адсорбтива;
Vм – емкость монослоя; 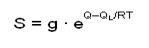
QL – теплота конденсации; Q – теплота адсорбции;
или S = g ∙ exp [(Q – QL)/RT]

Рис. 5.4
При малых P/P0 изотерма БЭТ переходит в изотерму Ленгмюра.
Достоинство:
1)учитывает полимолекулярность слоя адсорбтива.
Недостатки:
1) не учитывает латеральные взаимодействия.
На основе БЭТ – изотермы рассчитывают величину адсорбции для конкретных систем.
Дата добавления: 2014-11-13; просмотров: 947; Мы поможем в написании вашей работы!; Нарушение авторских прав |