
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Производная показывает изменение поверхностного натяжения с изменением концентрации, и называется поверхностной активностью.
Для поверхностно-активных веществ, у которых увеличение концентрации приводит к понижению поверхностного натяжения (  ) величина адсорбции Г будет положительной – вещество накапливается в поверхностном слое.
) величина адсорбции Г будет положительной – вещество накапливается в поверхностном слое.
Для поверхностно-неактивных веществ, у которых увеличение концентрации повышает поверхностное натяжение ( 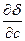
 > 0) величина адсорбции будет отрицательной. При этом концентрация вещества в поверхностном слое будет меньше, чем в объеме. Критерием поверхностной активности веществ является дифильность их молекул, то есть содержание в их составе полярной и неполярной частей ( например, полярной функциональной группы и неполярного углеводородного радикала)
> 0) величина адсорбции будет отрицательной. При этом концентрация вещества в поверхностном слое будет меньше, чем в объеме. Критерием поверхностной активности веществ является дифильность их молекул, то есть содержание в их составе полярной и неполярной частей ( например, полярной функциональной группы и неполярного углеводородного радикала)
Таким образом, и поверхностная активность и адсорбируемость вещества зависят от природы полярной группы (дипольного момента), строения молекулы и длины углеводородной цепи. Известно, что с удлинением углеводородной цепи органического соединения, растворимость его в воде падает.
У органических веществ одного гомологического ряда с увеличением длины углеводородной цепи на каждую группу – СН2 -поверхностная активность возрастает в 3,2 раза. Это правило Траубе-Дюкло.
Хемосорбция, или химическая осуществляемая на поверхности за счет химических сил имеет ряд отличительных особенностей :
1) необратимость ,
2) экзотермичность ,
3) с увеличением температуры скорость процесса увеличивается,
Зависимость количества адсорбированного вещества от его концентрации или давления в равновесном процессе при постоянной температуре может быть изображена графически изотермой адсорбции и аналитически в виде соответствующего уравнению изотермыУравнение изотермы адсорбции по Ленгмюру
Г = Г max 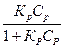
| 5.9 |
где Г —величина адсорбции , моль/кг,
Гmax — предельное количество адсорбционного вещества , максимальная адсорбция , кмоль/кг,
Кр — константа адсорбционного равновесия ,
Ср —равновесная концентрация растворенного вещества , кмоль/м3
Величину максимальной адсорбции Г и константу вещества ,кмоль/м3, равновесия Кр можно определить из изотермы по Ленгмюру (рис.5.9)
 Г, кмоль/кг
Г, кмоль/кг

 Гmax ◦
Гmax ◦
 С, кмоль/м3
С, кмоль/м3
Рис. 5.9. Изотерма адсорбции по Ленгмюру.
Кроме того существует эмпирическое уравнение Фрейндлиха (5.10,5.11) , позволяющее с помощью изотермы адсорбции определить численные значения констант адсорбции (К и 1/n ):
Х/m =KP1/n или Х/m = К С1/п 5.10
где Х/m — величина адсорбции на единицу массы адсорбента ,кмоль/кг,
Р, С р — равновесное давление или равновесная концентрация ,
К, 1/n — константы , характеризующие сродство адсорбента к адсорбтиву .
Чтобы найти значение константы К и 1/n , уравнение Фрейндлиха (5.11) преобразовывают в уравнение прямой линии , путем логарифмирования :
lg  = lgK + 1/n lgC (Р) = lgK + 1/n lgC (Р)
| 5.11 |
На оси абцисс откладывают значение lgСР , на оси ординат – lg x/m . Тогда тангенс угла наклона прямой к оси абцисс представляет величину 1/n , а отрезок , отсекаемый прямой на оси ординат , соответствует lgК (рис 5.10 ).
 lg Х/m
lg Х/m
 |
tg α=1/n

lgK
 C, кмоль/м3
C, кмоль/м3
Рис. 5.10 . Вид изотермы адсорбции по Фрейдлиху.
Наиболее сложной является адсорбция из растворов на твердой поверхности. На границе раздела твердое тело/ раствор различают два вида адсорбции молекулярную (из растворов неэлектролитов) и ионную (из растворов электролитов).
Мерой адсорбции служит изменение концентрации раствора на единицу массы твердого адсорбента .
Для экспериментального определения величины адсорбции
( Г ) пользуются уравнением Ловица :
Г = 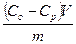 5.12
5.12
где: Со — начальная концентрация адсорбтива, кмоль/кг;
Ср— равновесная концентрация адсорбтива, кмоль/кг;
V— объем раствора, из которого происходит адсорбция, м3;
m— масса адсорбтива, кг.
Как правило, количество адсорбированного вещества увеличивается с ростом концентрации его в растворе ( С >), затем начинает преобладать ад
сорбция молекул растворителя ( С<) . Возможен случай, когда С~const ,то- есть адсорбция не происходит.
Процесс молекулярной адсорбции может быть описан изотермами и уравнениями Ленгмюра и Фрейндлиха ( рис 5.9 , 5.10 , 5.11).
Ионнообменная адсорбция (адсорбция твердое тело - раствор электролита) возникает под действием двух сил : молекулярно-поверхностных и электрических. Различают три основных вида адсорбции электролита :
1) эквивалентную,
2) специфическую ( или избирательную),
3) обменную.
При эквивалентной адсорбции происходит эквивалентное поглощение катионов и анионов электролитов, т.е. молекулы электролитов поглощаются целиком – лучше адсорбируемый ион электролита притягивает свой парный, менее адсорбируемый ион. При этом адсорбируемость второго иона возрастает, а первого –уменьшается, так как часть его удерживается в растворе другим, хуже адсорбируемым ионом. Часто эквивалентную адсорбцию называют молекулярной. Она характерна для слабых электролитов.
Специфическая адсорбция или адсорбция потенциалопределяющих ионов имеет большое значение в коллоидных системах при образовании двойного электрического слоя. В этом случае на твердом адсорбенте адсорбируются преимущественно только ионы одного вида, сообщая поверхности свой заряд.
Обменная адсорбция наиболее часто встречается в почве и сопровождается избирательным поглощением одного из ионов электролита с одновременным вытеснением другого иона того же знака из поверхности частичек почвы.
Мерой степени взаимного обмена ионов служит свободная энергия образования ионнообменника ( Δ F), выраженная уравнением изотермы обмена :
- Δ F =RTlgK 5.13
где К — константа ионного равновесия, определяющая соотношение ионов в поглощенном соотношении при заданной концентрации.
Кроме того, описывается уравнение Гапона-Никольского:
Г11/Z === К а11/Z == К С11/Z 5.14
Г2 1/Z а21/Z С21/Z
где Г1 и Г2 — количества поглощенных ионов, выраженные в мг-экв на 1 г адсорбента,
а1 и а2 — активности соответствующих ионов в растворе,
C1 и C2 — концентрации соответствующих ионов,
z1 и z2 — степени окисления обмениваемых ионов.
Если при обменной адсорбции вместо поглощаемого иона нейтральной соли адсорбент отдает в раствор эквивалентное количество ионов водорода или гидроксила, то такой вид адсорбции называется гидролитической.
Гидролитическая адсорбция играет большую роль в корневом питании растений. По К.К Гедройцу, носителем обменной адсорбции в почве является почвенный поглощающий комплекс. Он представляет собой высокодисперсную смесь нерастворимых в воде алюмосиликатных, органических и органоминеральных соединений.
При изучении ионного обмена в почве было доказано, что
а) обменная способность иона тем выше, чем больше его степень окисления,
б) у ионов одной валентности обменная способность возрастает с увеличением массы иона,
в) обмен ионами идет в строго эквивалентных количествах.
По интенсивности поглощения кислыми почвами, еще К.К. Гедройц экспериментально установил ряд катионов:
< Na+ < NH4+ < K+ < Mg2+ < Rb+
< Ca2+ < Cd2+ < Co2+ < Al3+ < H+
Представления Гедройца о катионном обмене в почвах легли в основу современного учения о поглотительной способности почвы, подвижности питательных веществ в почве, механизме поглощения почвами катионов и анионов и закономерностях структурообразования почвы как одного из факторов ее плодородия. По Гедройцу, анионы Cl—, NO3—, SO42— почти не поглощаются почвой. Поэтому считается, что азотное удобрение лучше вносить в виде аммиачной воды, так как нитратный азот селитры легко вымывается. От природы поглощенных ионов зависят агротехнические свойства почвы.
Процесс очистки от примесей различных систем осуществляется с помощью ионообменных смол (ионитов). Одни смолы имеют кислотный характер (поверхность их заряжена отрицательно ), потому они обменно адсорбируют только катионы (катиониты), другие— имеют основной характер (аниониты) . Применение ионитов позволяет устранить жесткость воды, изменять солевой состав молока, фруктовых соков, вина, воды и др.
Адсорбционные процессы лежат в основе важнейшего метода анализа сложных смесей- хроматографии. Впервые хроматографический метод анализа был открыт русским ботаником М.С. Цветом .Он использовал для целей разделения и очистки веществ их неодинаковую адсорбируемость на разных адсорбентах в присутствии различных жидких фаз.
В зависимости от механизма адсорбции растворенного вещества адсорбционная хроматография может быть разделена на два подвида: молекулярная хроматография и ионообменная хроматография. С помощью молекулярной - разделяют неэлектролиты в неводных растворах. Ионообменная хроматография используется для разделения ионов. Наши знания об антибиотиках, витаминах, алкалоидах, а также о динамике обмена веществ в растениях почти целиком получены методами хроматографии. Для хроматографического анализа требуются очень незначительные количества исследуемого вещества –десятые доли миллиграмма или микрограмма.
.
ЗАДАНИЯ К ЛАБОРАТОРНОЙ РАБОТЕ 5
Дата добавления: 2014-11-13; просмотров: 471; Мы поможем в написании вашей работы!; Нарушение авторских прав |