
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
ВВЕДЕНИЕ. Коллоидная химия изучает физико-химические свойства гетерогенных высокодисперсных систем и высокомолекулярных соединений в твердом состоянии и в растворах
Коллоидная химия изучает физико-химические свойства гетерогенных высокодисперсных систем и высокомолекулярных соединений в твердом состоянии и в растворах. Коллоидная химия — важный самостоятельный раздел физической химии. Коллоидная химия уделяет особое внимание роли поверхностных явлений на границе раздела фаз.
В настоящее время коллоидная химия занимается уже не только химическим строением и химическими реакциями, протекающими в коллоидных системах, но и физической структурой, физическими (и даже механическими) свойствами и физико-химическими процессами, характерными для высокодисперсных и высокомолекулярных систем. Вот почему правильнее было бы назвать этот раздел науки более общим термином — физическая химия дисперсных систем.
Из курса физической химии известно, что если одно вещество в более или менее раздробленном (дисперсном) состоянии равномерно распределено в массе другого вещества, то систему называют дисперсной. Раздробленное вещество в этом случае называют дисперсной фазой, а среду, в которой оно распределено, — дисперсионной средой. Так, система, представляющая собой взмученную в воде глину, состоит из взвешенных мелких частиц глины — дисперсной фазы и воды — дисперсионной среды.
Для характеристики и классификации различных дисперсных Систем в практике широко пользуются понятием степень дисперсности D, которая определяется как величина, обратная величине размера (диаметра) дисперсной частицы a:D=l/a м-1. Отсюда следует, что степень дисперсности есть величина, показывающая, какое число частиц можно уложить вплотную в 1 м.
Иногда применяется и другая характеристика степени дисперсности — так называемая удельная поверхность, которая представляет собой отношение поверхности S данного тела к занимаемому объему V, т. е. Sуд.=S/V, где Sуд. — удельная поверхность. С повышением степени дисперсности величина удельной поверхности быстро растет.
дисперсные системы по величине частиц дисперсной фазы и по степени дисперсности можно разделить условно на три группы: грубодисперсные, коллоидно-дисперсные и молекулярно (ионно)-дисперсные (табл. 6.1).
Дисперсные системы третьей группы, известные под общим названием истинных или молекулярных растворов, всесторонне исследуются в физической химии. Эти системы являются наиболее изученными, так как сравнительно просты по составу и структуре (дискретными единицами в них являются либо простые молекулы, либо ионы), а поведение определяется простыми и четкими
закономерностями. Молекулярно- и ионно-дисперсные системы могут образоваться самопроизвольно; они являются системами равновесными и термодинамически устойчивыми, подчиняющимися правилу фаз.
Таблица 6.1

Вторая группа дисперсных систем, получивших название коллоидно-дисперсных, является основным объектом изучения коллоидной химии. Системы этой группы получили название коллоидов или коллоидных систем. Структурной и кинетической единицей в них являются не ион и не молекула в общем смысле, а либо комплекс (агрегат), состоящий из обычных молекул, атомов или ионов, называемых мицеллой, либо макромолекула, т. е. молекула-полимер «гигантских» размеров ~100÷1 нм, обладающая молекулярной или частичной массой в десятки и сотни единиц.
С увеличением относительной молекулярной массы в дисперсных системах второй группы можно ожидать новых качественных изменений, т. е. появления новых,более сложных свойств, которые 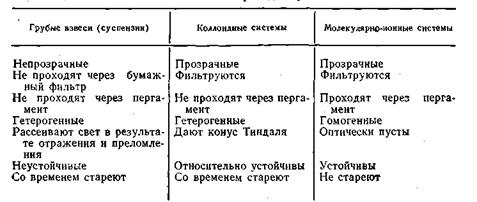
Таблица 6.2
не укладываются в закономерности более простых систем третьей группы. По мере изменения размеров частиц от наиболее крупных (грубодисперсных) к мелким и обратно соответственно изменяются кинетические, оптические, каталитические и другие свойства дисперсных систем. В табл. 6.2 приведены изменения некоторых свойств различных дисперсных систем.
Из этой таблицы следует, что коллоидно-дисперсные системы в отличие от истинных растворов сами по себе агрегативно неустойчивы. Размеры их дисперсных частиц могут изменяться как самопроизвольно, так и под влиянием внешних факторов. Одной из причин неустойчивости коллоидных растворов является их гетерогенность. Обладая громадной суммарной поверхностью, следовательно, большой свободной энергией, коллоидные системы согласно второму началу термодинамики стремятся к равновесному состоянию, характеризующемуся разделением системы на две фазы, имеющие минимальные межфазовые поверхности и минимальную свободную поверхностную энергию.
Агрегативная устойчивость коллоидно-дисперсных систем повышается, если на поверхности коллоидных частиц за счет свободной поверхностной энергии адсорбируются молекулы (ионы) третьего компонента системы – стабилизатора, Так, если в пробирку с водой ввести небольшое количество растительного масла, при встряхивании образуется эмульсия, которая быстро расслаивается снова на два слоя – масло и вода. Неустойчивость эмульсии объясняется самопроизвольным уменьшением суммарной поверхности за счет слипания мелких капелек масла в более крупные. Однако если ввести в эту смесь небольшое количество 2%-ного раствора мыла и хорошо встряхнуть, образуется стойкая эмульсия белого цвета. Мыло в данном случае играет роль стабилизатора.
В отличие от коллоидно-дисперсных систем высокомолекулярные системы значительно более устойчивы: они дают при смешении с растворителями молекулярные растворы, подобные обычным растворам низкомолекулярных веществ, но с очень длинными цепными молекулами. Такие растворы являются гомогенными системами, они образуются самопроизвольно, потому что сам процесс растворения идет с уменьшением свободной энергии и не требует наличия стабилизатора. Растворы высокомолекулярных соединений являются термодинамически равновесными и потому обратимыми системами.
Гетерогенные коллоидно–дисперсные и гомогенные высокомолекулярные системы обладают целым рядом общих свойств, что и делает их объектом изучения коллоидной химии.
Во многом близки к коллоидно–дисперсным системам и изучаются теми же методами суспензии, эмульсии и пены (D ≈ 105 ÷ 107 м-1). Хотя эти системы и обладают рядом особых специфических свойств, однако их следует причислить именно к коллоидным системам.
Коллоиды очень широко распространены в природе и играют важную практическую роль, чем и определяется не только научное, но и народнохозяйственное значение коллоидной химии. Драгоценные камни, а также другие минералы в недрах земли, пищевые продукты, одежда, обувь, дым, облака, мутная вода в природных водоемах, почва, глина – все это не что иное, как коллоидные системы. Такие биологические жидкости, как кровь, плазма, лимфа, спинно – мозговая жидкость, белки, крахмал, слизи и камеди, являются коллоидами.
Существенную роль играют коллоиды в промышленности, главным образом в таких ее отраслях, как добыча и переработка нефти, металлургическая промышленность, горнорудное дело, производство различных строительных материалов и пластмасс, синтетических волокон, синтетического каучука и резины, текстильная, лакокрасочная и пищевая промышленность, мыловаренное производство и т.д. Такие важные для промышленности технологические процессы, как обогащение полезных ископаемых путем флотации, механическая и термическая обработка металлов, технология фотографических и кинематографических процессов, имеют прямое отношение к коллоидно–дисперсным системам. В фармацевтической и парфюмерной промышленности многие лекарственные и бытовые препараты производятся в виде паст, кремов, мазей, тонких суспензий и эмульсий.
Исключительно важное значение имеет коллоидная химия в геологии. Представления о коллоидном состоянии вещества способствуют более углубленному пониманию процессов образования минералов, различных руд, горных пород и т. п.
В области почвоведения многие проблемы, например процессы ионного обмена, строение и свойства почвенного поглощающего комплекса, биохимия гумуса и др., также тесно связаны с коллоидной химией. Закономерности, устанавливаемые ею, дают возможность агроному не только глубже понимать процессы, протекающие в почве, но и в известной мере сознательно их изменять в желаемом направлении.
Велика роль коллоидной химии в вопросах химической защиты растений от различных вредителей и сорняков. В целях более высокой эффективности различные ядохимикаты применяются в виде суспензий, эмульсий, дымов и туманов (аэрозолей). Вот почему в системе агрономического образования коллоидной химии уделяется большое внимание. Такие важные для подготовки агронома научные дисциплины, как почвоведение, агрохимия, физиология растений и животных, метеорология, биохимия, микробиология и др., широко пользуются основными положениями и методами коллоидной химии.
Краткая история развития коллоидной химии. Как самостоятельная научная дисциплина коллоидная химия возникла в начале XX в., однако практические сведения о коллоидах можно найти уже в работах Аристотеля и алхимиков. Многие коллоидные системы и их свойства были хорошо известны человеку в глубокой древности и широко им использовались. Однако до середины XIX в., несмотря на успешное развитие естествознания, изучение и понимание коллоидов продвинулось очень мало. Объясняется это не только сложностью коллоидных систем, но и тем, что в XVIII и начале XIX вв. в естествознании господствовали идеалистические и вульгарно-механистические взгляды на сложные явления природы вроде учения о «жизненной силе» и т. п.
Русские ученые внесли неоценимый вклад в создание основ коллоидной химии. Так, в трудах М. В. Ломоносова (1751) четко различались явления кристаллизации и свертывания (коагуляция) растворов, описаны способы получения и свойства коллоидных растворов в воде и стекле (его знаменитые цветные стекла по существу являются твердыми растворами). Позднее Т. Е. Ловиц (1789) впервые открыл одно из важнейших явлений, на которых основана коллоидная химия,— адсорбцию из растворов на твердом адсорбенте (угле). Это свойство угля Ловиц успешно использовал в практических целях для осветления сахарного сиропа и растительных масел, а также для очистки селитры, которая применялась в производстве пороха.
В 1808 г. профессор Московского университета Ф. Ф. Рейсс впервые установил факт движения частичек дисперсной фазы и дисперсионной среды под влиянием внешнего электрического поля. Эти работы легли в основу изучения электрокинетических свойств коллоидно-дисперсных систем.
Большое значение имели работы итальянского химика Сельми, который еще в 1845 г., исследуя свойства различных растворов, заметил, что биологические жидкости — сыворотка, молоко, кровь, лимфа и другие — резко отличаются по своим свойствам от обычных истинных растворов; они были им названы псевдорастворами. Сельми доказал, что характерным отличием псевдорастворов (или ложных растворов) от истинных растворов является то, что образование их не сопровождается самопроизвольным раздроблением вещества на молекулы. Не менее важное значение имели работы Фарадея, который впервые (1857) открыл явление, получившее впоследствии название «эффекта Фарадея», а также разгадал секрет древних алхимиков — способ получения коллоидных растворов золота.
Однако началом классического периода в развитии коллоидной химии следует считать работы английского химика Грэма (1861), которого по праву считают «отцом» коллоидной химии. Он ввел термин и определил понятие «коллоиды». Изучая различные растворы, Грэм обнаружил, что одни вещества быстро диффундируют и проходят через растительные и животные мембраны, легко кристаллизуются. Другие обладают очень малой диффузией, не проходят через мембраны и не кристаллизуются, а образуют аморфные осадки. Так, например, сравнивая время диффузии различных растворенных веществ и принимая время диффузии НСl за единицу. Грэм получил сильно различающиеся значения:
HCl…………1,00 Сахар………….7,00
NaCl………..2,33 Белок…………49,0
MgSO4……..7,00 Карамель……..98,00
Как видим на этом примере, растворы можно разделить на две группы. В одну группу входят такие вещества, как NaCl, HCl, MgSO4 и сахар. Эти вещества хорошо диффундируют, легко проходят через поры животной и растительной перепонки (диализ). Во вторую группу входят белок и карамель, которые обладают ничтожно малой диффузией и не проходят через полупроницаемую перепонку.
Первые Грэм назвал кристаллоидами а вторые — коллоидами (от греческого слова kolla — клей и eidos — вид) или клееподобными веществами. Таким образом, все вещества он подразделил на два больших класса. Причем в отличие от обычных истинных растворов коллоидные растворы были названы Грэмом золями.
Против такого жесткого разделения химических веществ на коллоиды и кристаллоиды высказался в 60-х годах XIX в. профессор Киевского университета И. Г. Борщов (1833—1878), который независимо от Грэма дал определение сущности коллоидного раствора (золя) и коллоидной частицы. В частности, он выдвинул идею о кристаллической структуре коллоидных частиц, высказал близкое к современному представление о коллоидной мицелле и наличии определенной связи между поверхностью коллоидных частиц и молекулами растворителя. Работы И. Г. Борщова позволяют считать его зачинателем русской коллоидной химии и одним из основоположников коллоидной химии как науки вообще.
Позднейшие исследования подтвердили правоту высказывания И. Г. Борщова о том, что правильнее говорить не о коллоидах как об особой группе веществ, а о коллоидном состоянии вещества. Такой же точки зрения придерживался и Д. И. Менделеев, который полагал возможным получение любого вещества в соответствующей среде в коллоидном состоянии. Эту идею об универсальности коллоидного состояния вещества окончательно развил и экспериментально обосновал другой русский ученый П. П. Веймарн, которому удалось получить в коллоидном состоянии огромное количество веществ, считавшихся до него типичными кристаллоидами. Так, раствор мыла в воде обладает свойствами коллоида, а мыло растворенное в спирте, проявляет свойства истинных растворов. Аналогично этому типичный кристаллоид — поваренная соль, растворенная в воде, дает истинный раствор, а в бензоле — коллоидный раствор и т. п. В настоящее время любое вещество можно получить в коллоидном состоянии. Поэтому нельзя говорить о коллоидных веществах, а следует говорить о коллоидном состоянии тех или иных веществ.
Начало современного этапа развития коллоидной химии тесно связано с целым рядом замечательных открытий в области физики и смежных с ней наук в первые два десятилетия нашего века. За этот период произошла переоценка многих классических представлений. Разработка новых методов исследования, таких, как ультрамикроскопия (1904), рентгеноструктурный анализ (1913—1916), метод электронной микроскопии и др., позволила ученым глубже проникнуть в сущность строения коллоидов и вместе с тем далеко продвинуться в области теории. В учении о коллоидах в этот период на первый план выступает изучение поверхностносорбционных явлений. Эти явления были подробно исследованы русскими учеными А. А. Титовым (1910) и Н. А. Шиловым (1916), а также зарубежными — Ленгмюром (1917) и др. Успешное применение советским ученым А. В. Думанским центрифуги для изучения коллоидных систем послужило мощным толчком к разработке метода ультрацентрифугирования, который, по существу, является одним из важнейших современных методов исследования коллоидных растворов.
В решении проблемы устойчивости коллоидных систем и их коагуляции наряду с выдающимися работами таких крупных зарубежных ученых, как Дюкло, Фрейндлих и Кройт, весомый вклад внесли и наши советские ученые Н. П. Песков, А. И. Рабинович, П. А. Ребиндер и многие другие.
Большую известность у нас и за рубежом приобрели работы С. М. Липатова и В. А. Каргина в области исследования высокомолекулярных соединений. В частности, В. А. Каргин и его сотрудники подробно исследовали механизм процесса образования коллоидных частиц, экспериментально доказав наличие двух стадий в этом процессе.
В области исследования поверхностно-сорбционных слоев коллоидных систем большое значение приобрели работы А. Н. Фрумкина, Б. В. Дерягина и других советских ученых.
В нашей стране впервые были выполнены обширные и всесторонние исследования почвенных коллоидов. Выдающиеся работы К. К. Гедройца явились основополагающими в учении о почвенном поглощающем комплексе. Дальнейшее развитие наука о почвенных коллоидах получила в работах В. Р. Вильямса, А. Ф. Тюлина, И. Н. Антипова-Каратаева, А. Н. Соколовского, Н. П. Ремезова, С. Н. Алешина, Н. И. Горбунова, А. В. Петербургского и других советских ученых. Из зарубежных исследователей необходимо отметить работы Г. Вигнера и С. Маттсона.
Современная коллоидная химия включает следующие основные разделы:
1) молекулярно-кинетические явления (броуновское движение, диффузия) в дисперсных системах; гидродинамика дисперсных систем; дисперсионный анализ;
2) поверхностные явления: адсорбция (термодинамика и кинетика), смачивание, адгезия, поверхностно-химические процессы в дисперсных системах; строение и свойства поверхностных (адсорбционных) слоев;
3) теория возникновения новой (дисперсной) фазы в метастабильной (пересыщенной) среде; конденсационные методы образования дисперсных систем;
4) теория устойчивости, коагуляции и стабилизации коллоидно-дисперсных систем; строение частиц дисперсной фазы (мицелл);
5) физико-химическая механика дисперсных систем, включающая теорию механического диспергирования, явления адсорбционного понижения прочности твердых тел, реологию дисперсных систем; образование и механические свойства пространственных структур в дисперсных системах;
6) электрические и электрокинетические явления в дисперсных системах;
7) оптические явления в дисперсных системах (коллоидная оптика)—светорассеяние, светопоглощение; коллоидная химия фотографических процессов.
Дата добавления: 2014-11-13; просмотров: 638; Мы поможем в написании вашей работы!; Нарушение авторских прав |