
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Коллоидно-химические свойства протоплазмы.
Основным содержанием любой живой клетки является протоплазма — весьма сложная комплексная система, богатая водой и состоящая из ряда органических соединений. Главная роль в протоплазме принадлежит, безусловно, белкам, которые связаны с другими органическими соединениями, в первую очередь с липоидами, нуклеиновыми кислотами, гликогеном и др. Как показали многочисленные исследования, протоплазма характеризуется гомогенностью, нерастворимостью в воде, сократимостью, способностью к обратимым изменениям своего состава и вязкости.
По мнению ряда ученых, различные включения, встречающиеся в протоплазме живой клетки, не имеют принципиального значения для жизни и, по существу, являются специальными дифференцировками. Иными словами, в протоплазме могут быть, а могут и не быть, гранулы или вакуоли различной величины и в различном количестве. Протоплазма — бесцветное прозрачное вещество, которое получило специальное название гиалоплазмы.
Согласно современным представлениям протоплазму следует рассматривать как сложную коллоидную систему, обладающую всеми свойствами и признаками макромолекул в растворе. Исследования, проведенные за последние годы, убедительно показали, что протоплазма построена по типу сложных коацерватов. Как уже отмечалось, белки протоплазмы представляют собой сложные соединения более простых белков с нуклеиновыми кислотами, углеводами, высшими жирными кислотами и т. д. Именно при соединении с белком эти вещества образуют сложные коацерваты, из которых большое значение имеют так называемые внутрикомплексные коацерваты.
Протоплазма живой клетки обладает еще одним важным свойством, которое сближает ее с коллоидными растворами,— тиксотропностью. Тиксотропные свойства протоплазмы были обнаружены при исследовании разного рода течений протоплазмы, определением вязкости, а также прямыми опытами с помощью микроманипуляций. Исследования показали, что протоплазма стоит на грани между растворимостью и нерастворимостью в воде. В результате этого даже малейшего изменения условий внешнего или внутреннего порядка достаточно, чтобы изменить эти соотношения в пользу растворимости или нерастворимости.
Таким образом, по современным представлениям протоплазма является весьма подвижным тиксотропным студнем, который легко может переходить в золь, обладающий коацерватными свойствами. В основе этих превращений лежит функциональное состояние клетки.
Однако даже в состоянии золя протоплазма сохраняет пластичность, т. е. свойства твердого тела. Об этом свидетельствуют многочисленные опыты по падению в жидкой протоплазме посторонних микроскопических частиц. Из курса физики известно, что микроскопические тела падают в жидкости с постоянной скоростью (закон Стокса). В протоплазме же подобное падение идет с задержками, толчками, с отклонениями, как будто падающие частицы на своем пути встречают невидимые препятствия. На основании этих фактов был сделан вывод, что в протоплазме, даже в состоянии золя, имеется тончайший цитоскелет, основой которого являются вытянутые полипептидные цепи белка. Эти цепи взаимодействуют друг с другом своими боковыми цепями, образуют тончайшую сеть, т. е. молекулярный остов протоплазмы.
Основным свойством цитоскелета является его подвижность. При движении протоплазмы большое число точек скрепления боковых цепей полипептидных молекул непрерывно разрывается и вновь восстанавливается. Боковые цепи полипептидных молекул белка могут взаимодействовать друг с другом в точках сцепления путем образования водородных связей или же за счет сил Ван-дер-Ваальса.
В петлях цитоскелета находятся разнообразные глобулярные белки, молекулы которых при развертывании сами могут превращаться в скелетные образования. Внутри цитоскелета находятся и другие органические и неорганические вещества, а также вода. Протоплазма живой клетки представляет собой полифазную коллоидную систему, состоящую из высокомолекулярных соединений, диспергированных в водной среде.
Однако в отличие от тел неживой природы, характеризующихся постоянством состава и формы, протоплазма сохраняет свое постоянство в результате непрерывно идущих процессов обмена.
«Жизнь,— говорит Ф. Энгельс,— есть способ существования белковых тел, и этот способ существования состоит по своему существу в постоянном самообновлении химических составных частей этих тел». Это положение остается и по сей день неоспоримым, и только исходя из него можно правильно анализировать различные биологические явления.
Вопросы для самоподготовки
1.Классификация дисперсных систем. Основные методы получения и условия образования коллоидов.
2.Опишите строение коллоидной частицы-мицеллы и приведите примеры.
3.Каковы физические, оптические и молекулярно-кинетические свойства коллоидных систем.
4.Что такое термодинамический и электрокинетический потенциал? Где они образуются? Опишите явление электрофореза и электроосмоса.
5.Опишите устойчивость коллоидных систем, укажите виды и факторы устойчивости (по Пескову).
6.Коагуляция дисперсных систем. Дайте определение порога коагуляции и сформулируйте правила коагуляции – Шульца-Гарди.
7.Охарактеризуйте явления синергизма, антогонизма и аддитивности ионов.
8.Покажите схематично строение белковой молекулы и укажите факторы ее устойчивости. Что такое ИЭТ и ИЭС.
Коллоидные системы — это один из видов дисперсных систем малорастворимых в данной среде веществ (лиофобных) с размерами частиц дисперсной фазы от1 до 100 нм ,(1 нм = 10-9 м )
Частицы коллоидных растворов не оседают под действием сил тяжести, проходят через бумажные фильтры, но задерживаются растительными и животными мембранами. Они имеют сложную структуру, зависящую от состава дисперсной фазы, дисперсной среды и условий получения коллоидов. .Необходимыми и достаточными условиями их образования являются:
а) достижение частиц размерами 10-9 – 10-7 м;
б) малая растворимость дисперсной фазы в дисперсионной среде;
в)присутствие третьего компонента, играющего роль стабилизатора.
Требования к стабилизатору — содержание в его составе родственных ионов с веществом ядра (специфическая или избирательная адсорбция)
Коллоидная частица называется мицеллой, а жидкость, в которой находятся мицеллы — интермицеллярной. Последняя содержит в растворенном состоянии различные вещества , в том числе и ионы стабилизатора , а также ионы не пошедшие на образование коллоидных частиц.
Схема строения мицеллы, (например, золя хлорида серебра), может быть представлена :

 х-
х-
[mAgCl] n Сl—- · (n – x) К+ хК+

 ядро потенциалопределяющие противоины
ядро потенциалопределяющие противоины

 ионы
ионы

 гранула
гранула
 |
 мицелла
мицелла
Как видно из строения, потенциалопределяющими являются ионы, имеющие сродство (кристаллическую решетку) с ядром
( т.есть ионы Сl— ).
Противоионы притягиваются за счет сил электростатического притяжения.
Мицелла является электронейтральной частицей, а гранула несет заряд, соответствующий по заряду потенциалопределяющих ионов.
Коллоидные растворы обладают своеобразными молекулярно – кинетическими, оптическими и электрическими свойствами. По молекулярно – кинетическим свойствам они характеризуются малыми значениями коэффициента диффузии и величины осмотического давления, а также незначительным броуновским движением, что обусловлено крупными размерами частиц .
Для них характерно явление седиментации – процесс оседания частиц под действием силы тяжести. Если в системе силы тяжести полностью уравновешены силами диффузии и броуновского движения наступает так называемое седиментационное равновесие, которое характеризуется равенством скоростей седиментации и диффузии.
Из оптических свойств коллоидных растворов особенно ярко проявляется светорассеивание (опалесценция и эффект Фарадея – Тиндаля). Закон Релея устанавливает зависимость интенсивности светорассеивания от размера частиц, количества частиц в объеме раствора и длины волны падающего света и может быть описан уравнением:
n*V2
I = I0*K ———— 6.21
l4
где I — интенсивность светорассеивания,
I0 — интенсивность падающего света,
n — число частиц ,
V — объем частиц,
l — длина волны падающего света, нм
K — коэффициент светорассеивания.
Явление светорассеяния в конусе Фарадея –Тиндаля лежит в основе одного из важнейших методов исследования высокодисперсных систем –ультрамикроскопии.
Если через коллоидный раствор пропускать постоянный ток, то к одному из электродов будут передвигаться ядра мицелл вместе с потенциалопределяющими ионами и противоионами адсорбционного слоя, то есть, основная часть всей мицеллы (гранула). Противоионы диффузного слоя будут передвигаться к другому электроду .
Движение дисперсных частиц под влиянием электрического поля называется электрофорезом. Движение же жидкости через мембрану при наложении внешней разности потенциалов является электроосмосом. Методами электрофореза и элекроосмоса можно определить скорость движения и знак заряда коллоидных частиц (гранул), а также рассчитать величину электрокинетического потенциала.
Электрокинетический, или дзета – потенциал (x - потенциал) возникает между подвижным адсорбционным слоем и внешней подвижной жидкостью при перемещении дисперсной фазы относительно дисперсионной среды. Величина x - потенциала прямо пропорциональна скорости движения частиц золя в электрическом поле:
U *h
x = ———— 6.22
e *D
где U — скорость электрофореза , м/с В,
h — вязкость среды, Н с/м (для воды h=1,13*10-5)
D — диэлектрическая постоянная среды (для воды
D=81)
e —электрическая постоянная –8,85*1012 Ф/м
По величине дзета – потенциала в большинстве случаев можно судить об относительной агрегативной устойчивости коллоидных систем .
В прямой зависимости от электрокинетического потенциала находится относительная вязкость гидрофобных золей. С возрастанием дзета – потенциала увеличивается относительная вязкость золя, что объясняется возрастанием концентрации противоионов, а следовательно, увеличением объема коллоидных частиц . Измерение вязкости имеет большое значение при изучении природы коллоидных растворов.
В коллоидных системах вследствие большой поверхности раздела между фазами имеется избыток свободной поверхности энергии. Поэтому им свойственны процессы, сопровождающиеся убыванием свободной энергии (адсорбция и коагуляция )
Коагуляция – это процесс слипания (агрегации) коллоидных частиц, которая вызывается механическими, температурными, электрическими и др. воздействиями, а также добавлением электролитов.
Экспериментально установленные закономерности коагуляции электролитами (правила коагуляции) сводятся к нижеследующему:
1) коагуляцию вызывают любые электролиты, но с заметной скоростью она начинается лишь по достижению определенной концентрации. Минимальное количество электролита, способного вызвать коагуляцию, называют «порогом коагуляции» и рассчитывают по формуле:
СЭ*VЭ
g = ———— 6.23
WЭ
где Сэ — концентрация электролита, кмоль/м3;
V э —объем электролита, м3;
Wэ —объем золя, м3;
2) коагулирующим действием обладает лишь тот ион электролита, заряд которого противоположен заряду коллоидной частицы, причем его коагулирующая способность тем сильнее, чем выше степень окисления; для одно-, двух- и трехзарядных ионов коагулирующая сила соотносится как 1:50:1000 (правило Шульца-Гарди);
3) в ряду органических соединений их коагулирующее действие возрастает с повышением адсорбционной активности;
4) в ряду неорганических ионов одинаковой степени окисления их коагулирующая способность возрастает с уменьшением степени гидратации
Li+, Na+, K+, Rb+ лиотропный ряд
 |
возрастание коагулирующей способности
5) началу коагуляции способствует снижение ζ (дзета) – потенциала до 0,03 В;
6) в осадках, получаемых при электролитной коагуляции, всегда присутствуют ионы, ее вызывающие.
При одновременном действии на коллоидную систему нескольких электролитов коагуляция приобретает весьма сложный характер. Чаще всего это наблюдается в природных коллоидных системах, например в почвах.
Если находящиеся в смеси электролиты действуют на данную коллоидную систему каждый соответственно своей коагулирующей способности, то коагулирующее действие смеси складывается (суммируется ) из действий каждого электролита в отдельности. Такое действие называется аддитивным и оно имеет место когда ионы –коагуляторы имеют одинаковую степень окисления и близкие степени гидратации. Например, смесь NaCl и KCl
Иногда смесь электролитов оказывает более слабое коагулирующее действие, чем каждый из компонентов смеси в отдельности, это- антогонизм ионов. Например, KCl и MgCl 2 .
В некоторых же случаях наблюдается усиление коагулирующей способности смеси электролитов, это явление синергизма.
Коагуляция коллоидов может наступать не только под действием электролитов, но и при смешивании двух золей с противоположными зарядами коллоидных частиц. Такой вид коагуляции называют взаимной коагуляцией.. Примером такой коагуляции может быть взаимная коагуляция отрицательно заряженного золя берлинской лазури и положительно заряженного золя Fe (OH) 3 ( см. опыт 6).
Иногда, при добавлении электролита к коллоидному раствору (особенно при добавлении поливалентных электролитов) происходит не коагуляция, а наоборот, стабилизация золя за счет явления перезарядки ионов. На поверхности коллоидной частицы при этом происходит обменная адсорбция и перемена знака заряда частицы. Так , например , бывает при добавлении раствора FeCl 3 к коллоидному раствору берлинской лазури ( см. опыт3).
Для практических целей иногда важное значение имеет защита коллоидов от коагуляции. Коллоидную защиту можно осуществить добавлением к золям растворов высокомолекулярных соединений (ВМС). Количественную характеристику защитных свойств лиофильных коллоидов по отношению к лиофобным коллоидным растворам по предложению Зигмонди принято выражать в относительных числах : золотом, рубиновом и железном.
В плодородных почвах черноземного типа содержатся в больших количествах высокомолекулярные гумусовые вещества и, в частности, гуминовые и фульвокислоты. Указанны лиофильные вещества, находясь в растворенном состоянии оказывают защитное действие по отношению к почвенным коллоидам. К сожалению, защищенные гуминовыми кислотами частицы гумуса, находясь в дисперсном или обратимом состоянии вымываются из почвы атмосферными осадками, что не только лишает почву наиболее ценной ее части, но и снижает содержание водопрочных агрегатов и нарушает ее структурность.
Некоторые золи, например золь Fe (OH) 3 , в процессе старения при добавлении электролитов в количествах меньших, чем это необходимо для коагуляции, могут со временем только загустеть и превратиться в студень (гель).При механическом воздействии ( встряхивание), или при медленном нагревании, связь между частицами дисперсной фазы нарушается и гель вновь приобретает прежнюю подвижность и превращается в золь. Такое явление обратимого перехода : золь --- гель называют тиксотропией.
Явление тиксотропии встречается и в природе .Например, некоторые грунты ( плывуны) под влиянием производимого на них механического или гидродинамического воздействия размягчаются и «плывут», а при снижении температуры или уменьшении усилия механического воздействия вновь затвердевают, что объясняется их тиксотропными свойствами.
Растворы высокомолекулярных соединений, в отличие от коллоидных, гомогенных, термодинамически устойчивы и являются молекулярно-ионными системами. Частицы их представляют клубки отдельных нитеобразных сильно сольватированных молекул, соединенных по местам несольватированных групп.
Как и коллоиды, растворы ВМС не проходят через животные и растительные мембраны, обладают малыми скоростями диффузии, рассеивают свет.
Процессу растворения ВМС предшествует набухание – проникновение молекул растворителя в среду ВМС и связанное с этим увеличение его массы и объема. Скорость этого процесса зависит от ряда факторов: давления, температуры, рН среды, присутствия посторонних примесей и др .
Способность к набуханию ВМС количественно можно охарактеризовать степенью набухания ( α ) , которая равна:
V –V0
α = ——— 6.24
V0
где: Vo - объем до набухания, см3;
V - объем после набухания, см3.
Набухание имеет очень большое значение в природе, в жизнедеятельности человека, во многих производствах. Так, прорастание зерна, образование опухолей, сокращение мышц, акт пищеварения, кожгалантерейное производство, кулинарная обработка продуктов питания и др,— неосуществимо без предварительного набухания .
Особую роль ВМС представляют белки и нуклеиновые кислоты. Они играют основную роль во всех жизненных процессах и являются теми веществами, с которыми неразрывно связано само понятие жизни.
По химическому составу белки представляют собой полипептиды, состоящие из разнообразных аминокислот, которые могут быть выражены общей формулой:
NH2

 R
R
СООH
Белки относятся к так называемым высокомолекулярным электролитам или полиэлектролитам. Наличие свободных аминных (-NH2) и карбоксильных (- СООН) групп сообщает белкам амфотерные свойства, и ведут себя в водных растворах
в кислотной среде – как основание -

 NH2 NH3+
NH2 NH3+
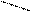
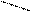 R + Н+ ↔ R
R + Н+ ↔ R
СООH СООH
в щелочной среде – как кислота

 NH2 NH2
NH2 NH2

 R + ОН—↔ R + Н2O
R + ОН—↔ R + Н2O
СООH СОО—
В нейтральном состоянии белковая молекула существует преимущественно в виде амфотерного биполярного иона
 NH+3
NH+3
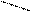 R
R
СОО --
что соответствует изоэлектрическому состоянию белка (ИЭС).
Значение рН среды, при котором белок находится в ИЭС, называется изоэлектрической точкой (ИЭТ) белка. В ИЭТ у молекулы белка меняется форма и степень гидратации, что влечет за собой изменения и других свойств раствора белка, таких как набухание и растворимость макромолекул, вязкость и светорассеяние растворов. Поэтому определение ИЭТ белка необходимо и возможно как прямыми, так и косвенными методами (см. опыт 10).
Основными факторами устойчивости лиофильных растворов ВМС является сольватация, поэтому процесс их коагуляции связан с лишением частиц сольватной оболочки. Немаловажно и наличие электрического заряда у некоторых ВМС, обусловленное их амфотерностью. Коагуляция белковых ВМС происходит в изоэлектрической точке (ИЭТ) при добавлении к ним десольватирующих веществ ( например C2H5OH ) или электролитов, которые уменьшают взаимодействие частиц дисперсной фазы со средой. Потеряв сольватную оболочку и заряд, ВМС коагулируют (см. опыт 9). Ассортимент электролитов, вызывающих коагуляцию ВМС, очень велик, концентрации их близки к насыщению. Процесс коагуляции растворов ВМС электролитами называется высаливанием. Высаливающая способность различных ионов при одинаковой степени окисления различна и здесь решающую роль играет не зарядность иона, а их способность к гидратации. По своему высаливающему действию все катионы и анионы можно расположить в лиотропные ряды
C2O42- SO4 CH3COO- Cl- NO3- J - CNS –
Li + Na + K + Rb+ Cs + Mg 2+ Ca2+ Sn2+ Ba2+
Основная роль в высаливании , как и в набухании, принадлежит анионам, катионы же оказывают меньшее воздействие на высаливание.
Дата добавления: 2014-11-13; просмотров: 3014; Мы поможем в написании вашей работы!; Нарушение авторских прав |