
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Внутренняя энергия и количество теплоты. Теплоемкость.
На деятельность сердца и сосудов оказывают влияние химические вещества, находящиеся в крови. Так, в надпочечниках вырабатывается гормон адреналин. Он учащает и усиливает деятельность сердца и суживает просвет кровеносных сосудов. В нервных окончаниях парасимпатических нервов образуется ацетилхолин, который расширяет просвет кровеносных сосудов и замедляет и ослабляет сердечную деятельность. На работу сердца оказывают влияние и некоторые соли. Увеличение концентрации ионов калия тормозит работу сердца, а увеличение концентрации ионов кальция вызывает учащение и усиление сердечной деятельности.
Гуморальные влияния тесно связаны с нервной регуляцией деятельности системы кровообращения. Выделение самих химических веществ в кровь и поддержание их определенной концентрации в крови регулируется нервной системой.
Деятельность всей системы кровообращения направлена на обеспечение организма в разных условиях необходимым количеством кислорода и питательных веществ, на выведение из клеток и органов продуктов обмена, сохранение на постоянном уровне кровяного давления. Это создает условия для сохранения постоянства внутренней среды организма.
10.7. Возрастные особенности реакции сердечно-сосудистой системы на физическую нагрузку.
На динамическую физическую нагрузку дети и подростки реагируют повышением частоты сердечных сокращений, максимального артериального давления (ударного объема). Чем младше дети, тем в большей мере, даже на меньшую физическую нагрузку, они реагируют повышением частоты пульса, меньшим увеличением ударного объема, обеспечивая примерно одинаковый прирост минутного объема.
Дети и подростки, систематически занимающиеся физической культурой, постоянно выполняющие общественно полезные работы при строгом нормировании физических нагрузок, тренируют сердце, повышают его функциональные возможности.
Наступающая тренированность обусловливает предельную экономичность работы сердца, увеличение его резервных возможностей, повышение работоспособности и выносливости. Это четко проявляется в реакциях тренированных детей и подростков по сравнению с нетренированными сверстниками. Минутный объем сердца тренированные дети и подростки по сравнению со своими нетренированными сверстниками обеспечивают за счет увеличения ударного объема и в меньшей степени за счет частоты сердечных сокращений. Проявляется и другая примечательная особенность: время восстановления гемодинамических показателей у тренированных учащихся короче, чем у нетренированных.
Статическая нагрузка сопровождается иными реакциями сердечно-сосудистой системы. Сидение - активное состояние, при котором сильное напряжение испытывают около 250 мышц. Максимальная нагрузка приходится на затылочные, спинные мышцы-разгибатели, а также мышцы тазового пояса. Статическая нагрузка в отличие от динамической повышает как максимальное, так и минимальное артериальное давление.
Длительная статическая нагрузка сопровождается у учащихся спазмом артериол, что приводит к общему повышению артериального давления. Увеличение двигательной активности в режиме учебных занятий - одна из мер профилактики у учащихся сердечно-сосудистых расстройств, в частности развития гипертонии. Занятия физической культурой и трудом в пределах возрастных границ допустимых физических нагрузок - наиважнейшая мера укрепления сердца.
Основные понятия термодинамики. Закон равномерного распределения энергии по степеням свободы.
В отличие от МКТ термодинамика изучает макроскопические свойства тел и явлений природы, не интересуясь их микроскопической картиной. Не вводя в рассмотрение атомы и молекулы, не входя в микроскопическое рассмотрение процессов, термодинамика позволяет делать целый ряд выводов относительно их протекания.
В основе термодинамики лежит несколько фундаментальных законов (называемых началами термодинамики), установленных на основании обобщения большой совокупности опытных фактов.
Подходя к рассмотрению изменений состояния вещества с различных точек зрения, термодинамика и МКТ взаимно дополняют друг друга, образуя по существу одно целое.
Термодинамика - раздел физики, изучающий общие свойства макроскопических систем, находящихся в состоянии термодинамического равновесия, и процессы перехода между этими состояниями.
Термодинамический метод основан на введении понятия энергии и рассматривает процессы с энергетической точки зрения, т. е. основываясь на законе сохранения энергии и превращении её из одного вида в другой.
Термодинамическая система - совокупность тел, которые могут обмениваться энергией друг с другом и с внешней средой.
Для описания термодинамической системы вводятся физические величины, которые называются термодинамическими параметрами или параметрами состояния системы : р,V,T.
Физические величины, характеризующие состояние термодинамической системы, называются термодинамическими параметрами.
Давлением называется физическая величина, численно равная силе, действующей на единицу площади поверхности тела по направлению нормали к этой поверхности: 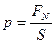 ,
, 
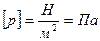 .
.
Нормальное атмосферное давление 1атм=105 Па.
Абсолютная температура - мера средней кинетической энергии молекул.
 .
.
Состояния, в которых находится термодинамическая система, могут быть различными.
Если один из параметров в различных точках системы неодинаков и изменяется с течением времени, то такое состояние системы называется неравновесным.
Если все термодинамические параметры остаются постоянными во всех точках системы сколь угодно долго, то такое состояние называется равновесным или состоянием термодинамического равновесия.
Любая замкнутая система по истечении определенного времени самопроизвольно переходит в равновесное состояние.
Всякое изменение состояния системы, связанное с изменением хотя бы одного из её параметров, называется термодинамическим процессом. Процесс, в котором каждое последующее состояние бесконечно мало отличается от предыдущего, т.е. представляет собой последовательность равновесных состояний, называется равновесным.
Очевидно, что все равновесные процессы протекают бесконечно медленно.
Равновесный процесс может быть проведен в обратном направлении, причем система будет проходить через те же состояния, что и при прямом ходе, но в обратной последовательности. Поэтому равновесные процессы называют обратимыми.
Процесс, при котором система после ряда изменений возвращается в исходное состояние, называется круговым процессом или циклом.
Все количественные выводы термодинамики строго применимы только к равновесным состояниям и обратимым процессам.
Число степеней свободы – число независимых координат, полностью определяющих положение системы в пространстве. Молекулу одноатомного газа можно рассматривать как материальную точку, обладающую тремя степенями свободы поступательного движения.
Молекула двухатомного газа – совокупность двух материальных точек (атомов), жестко связанных недеформируемой связью; кроме трех степеней свободы поступательного движения имеет еще две степени свободы вращательного движения (рис. 1).
Трех- и многоатомные молекулы имеют 3+3=6 степеней свободы (рис. 1).
Естественно, что жесткой связи между атомами не существует. Поэтому для реальных молекул (кроме одноатомных) следует учитывать и степени свободы колебательного движения.
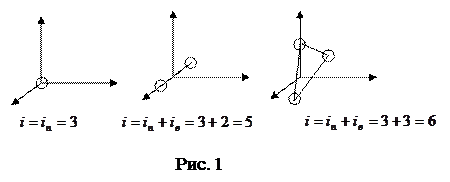 |
Как было показано ранее, средняя кинетическая энергия поступательного движения молекулы равна
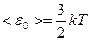 .
.
Поскольку каждая молекула всегда обладает тремя степенями свободы поступательного движения и ни одна из этих степеней не имеет преимущества перед другими, на каждую степень свободы поступательного движения приходится энергия, равная
 .
.
Т.к. движение молекул является хаотическим, то любое движение – поступательное и вращательное - является равновероятным. Из этого предположения следует один из важнейших законов статистической физики – закон Больцмана о равномерном распределении энергии по степеням свободы молекул: на каждую степень свободы поступательного и вращательного движения молекулы приходится в среднем одинаковая кинетическая энергия, равная  .
.
Для реальных молекул на каждую колебательную степень свободы приходится как кинетическая, так и потенциальная энергия.
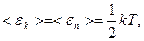 поэтому
поэтому  .
.
Таким образом, средняя кинетическая энергия молекулы
 ,
,
где i – число степеней свободы молекулы.
Внутренняя энергия и количество теплоты. Теплоемкость.
Внутренняя энергия термодинамической системы - энергия движения и энергия взаимодействия микрочастиц системы (молекул, атомов, электронов, ядер и т.д.).
Т.к. потенциальная энергия молекул идеального газа равна нулю, внутренняя энергия идеального газа равна суммарной кинетической энергии всех его молекул:

Изменение внутренней энергии:
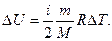
Внутреннюю энергию можно изменить 2-мя способами:
1) совершив работу;
2) при теплопередаче.
Теплопередачей называют совокупность процессов между молекулами вещества, приводящих к передаче энергии.
Изменение внутренней энергии системы при теплопередаче характеризуется количеством теплоты. Количество теплоты - мера изменения внутренней энергии при теплопередаче.
[Q]=Дж.
Первые экспериментальные измерения теплоты были выполнены в 1750 - 1751 г. в Петербурге Г.В. Рихманом. Им было установлено, что количество теплоты Q, переданное телу или отнятое у него, прямо пропорционально его массе и изменению температуры:
 .
.
Коэффициент пропорциональности получил название удельной теплоёмкости.
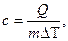
 .
.
Удельной теплоемкостью вещества называется физическая величина, равная количеству теплоты, необходимому для нагревания единицы массы вещества на один градус.
Молярной теплоёмкостью вещества называется величина, равная количеству теплоты, необходимому для нагревания 1 моля вещества на 1 градус.
 , C=
, C= 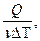
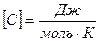
Поскольку
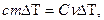 или
или 

 ,
,  .
.
Величина теплоёмкости зависит от условий нагревания.
Различают теплоёмкости при постоянном объёме и при постоянном давлении:
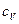 и
и 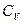 при V=const,
при V=const,
 и
и  при p=const.
при p=const.
Можно доказать, что 
 ,
,
 - уравнение Майера.
- уравнение Майера.
Величина 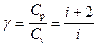
представляет собой характерную для каждого газа величину, которая зависит от числа атомов в молекуле газа; она называется коэффициентом Пуассона.
Для одноатомного газа i = 3,  ,
,
для двухатомного i = 5, 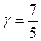 ,
,
для многоатомного i = 6,  .
.
Дата добавления: 2014-12-03; просмотров: 396; Мы поможем в написании вашей работы!; Нарушение авторских прав |