
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Первый закон термодинамики и его применение к изопроцессам.
 Работа и теплота связаны друг с другом. Опыты Джоуля и Роберта Майера показали, что работа и теплота переходят друг в друга в эквивалентных количествах. Однако теплота и работа неравноценны: работа может полностью перейти в теплоту, а теплота полностью перейти в работу не может. Причины этого объясняются началами термодинамики.
Работа и теплота связаны друг с другом. Опыты Джоуля и Роберта Майера показали, что работа и теплота переходят друг в друга в эквивалентных количествах. Однако теплота и работа неравноценны: работа может полностью перейти в теплоту, а теплота полностью перейти в работу не может. Причины этого объясняются началами термодинамики.
I закон термодинамики:
 .
.
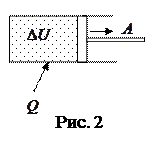
Количество теплоты 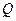 , переданное системе, идет на увеличение её внутренней энергии
, переданное системе, идет на увеличение её внутренней энергии 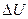 и совершение системой работы
и совершение системой работы 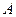 против внешних сил (рис. 2).
против внешних сил (рис. 2).
Первое начало термодинамики подтверждается как теми опытами, на основании которых установлена эквивалентность между Q и A,так и совпадением выводов из него с наблюдаемыми фактами. Оно является выражением закона сохранения и превращения энергии.
Установление первого начала термодинамики позволило объяснить все неудачи, связанные с попыткой создания машины, которая могла бы совершать работу, не получая энергии извне (перпетуум мобиле, или вечный двигатель первого рода). После формулировки первого закона термодинамики стало ясно, что если система не получает извне тепла или другой энергии, то Q= и DU=, поэтому и A= Таким образом, создать вечный двигатель первого рода невозможно. Это утверждение является одной из формулировок первого начала термодинамики.
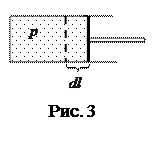
Работа, совершаемая системой при изменении объема, определяется следующим образом.
Пусть газ заключен в некотором цилиндре (рис. 3); найдем его работу при расширении.
Элементарная работа на пути 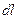
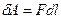 ,
,
где 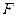 - сила, с которой газ давит на поршень.
- сила, с которой газ давит на поршень.
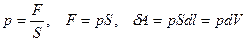 .
.
Работа, совершаемая системой при конечном изменении объёма от 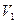 до
до 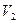 , находится интегрированием:
, находится интегрированием:
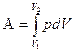 .
.
Произведенную при том или ином процессе работу можно изобразить графически с помощью кривой в координатах 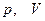 .
.
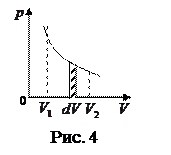 При увеличении объёма на
При увеличении объёма на 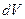 совершаемая газом работа
совершаемая газом работа 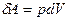 определяется заштрихованной площадью.
определяется заштрихованной площадью.
Поэтому полная работа, совершаемая при расширении от 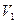 до
до 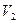 , определяется площадью, ограниченной осью абсцисс, кривой
, определяется площадью, ограниченной осью абсцисс, кривой 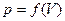 и прямыми
и прямыми 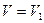 и
и  (рис. 4).
(рис. 4).
При p=const
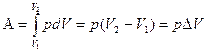 .
.
Как было ранее установлено,
 .
.
1. Изохорный процесс (V=const).

Диаграмма этого процесса в координатах p,V изображается прямой, параллельной оси ординат. Газ при этом не совершает работы, A=.
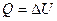 .
.
Вся теплота, сообщаемая газу, идёт на увеличение его внутренней энергии.
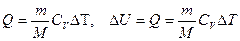 .
.
2. Изобарный процесс (p=const).

 ,
,
 .
.
Т.к. p=const,  ,
, 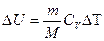 .
.
3.Изотермический процесс (T=const).

Т.к. Т = const, DT=0, DU=, Q=A,
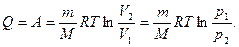
Адиабатным называется процесс, происходящий в системе без теплообмена с внешней средой.
Близкими к адиабатным являются все быстропротекающие процессы, например, быстрое сжатие или расширение, происходящее так, чтобы система не успела обменятся теплом с внешней средой.
Адиабатные процессы применяются в двигателях внутреннего сгорания (расширение и сжатие горючей смеси в цилиндрах), в холодильных установках и т.п.)
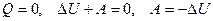 – адиабатное расширение, температура уменьшается.
– адиабатное расширение, температура уменьшается.
 Работа газа над внешними телами совершается за счет его внутренней энергии. При этом его внутренняя энергия (и температура) уменьшается. Т.о., при адиабатном расширении газ охлаждается.
Работа газа над внешними телами совершается за счет его внутренней энергии. При этом его внутренняя энергия (и температура) уменьшается. Т.о., при адиабатном расширении газ охлаждается.
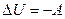 – адиабатное сжатие, температура растет. Внутренняя энергия увеличивается за счет работы внешних сил над газом.
– адиабатное сжатие, температура растет. Внутренняя энергия увеличивается за счет работы внешних сил над газом.
Уравнение адиабатного процесса или уравнение Пуассона:
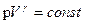 ,
,
где 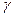 – показатель адиабаты или коэффициент Пуассона.
– показатель адиабаты или коэффициент Пуассона.
Это же уравнение имеет другие формы записи:
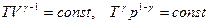 .
.
Работа, совершаемая газом при адиабатном процессе, выражается формулами:
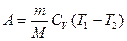 или
или 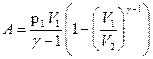 .
.
Дата добавления: 2014-12-03; просмотров: 277; Мы поможем в написании вашей работы!; Нарушение авторских прав |