
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Сведения из теории. Состояние газа характеризуется тремя величинами - параметрами состояния: давлением Р, объемом V и температурой Т
Состояние газа характеризуется тремя величинами - параметрами состояния: давлением Р, объемом V и температурой Т. Уравнение, связывающее эти величины, называется уравнением состояния газа. Для идеального газа уравнением состояния является уравнение Менделеева-Клапейрона:
 ,
,
где М - масса газа; m - масса одного моля; R - универсальная газовая постоянная.
Для одного моля:
PV = RT . (7.1)
Теплоемкостью теланазывается количество теплоты, которое нужно сообщить телу, чтобы изменить его температуру на один градус:
 (Дж/К).
(Дж/К).
Здесь dT - изменение температуры тела при сообщении ему количества теплоты dQ.
Теплоемкость единицы массы тела называется удельной теплоемкостью:
 (Дж/(кг·К)).
(Дж/(кг·К)).
Теплоемкость одного моля вещества называется молярной теплоемкостью:
 (Дж/(моль·К)) . (7.2)
(Дж/(моль·К)) . (7.2)
Величина теплоемкости газа зависит от условий его нагревания, т. е. от того, нагревается ли газ при постоянном объеме (обозначим молярную теплоемкость в этом случае через Сv ) или процесс нагревания происходит при постоянном давлении (Ср ). Теплоемкости Ср и Сv связаны между собой. Эту связь можно получить, пользуясь уравнением состояния (7.1), написанным для одного моля газа, и первым началом термодинамики, которое можно сформулировать следующим образом: количество теплоты dQ, переданное системе, затрачивается на увеличение ее внутренней энергии dU и на работу dA, совершаемую системой над внешними телами:
dQ = dU + dA.(7.3)
Элементарная работа
dA = P× dV . (7.4)
Исходя из определения молярной теплоемкости (7.2)
 .
.
При изохорическом процессе V = соnst, следовательно, dV = 0 и dA= 0 (см. формулу (7.4)), поэтому
 . (7.5)
. (7.5)
При изобарическом процессе Р =соnst,следовательно,
 . (7.6)
. (7.6)
Из уравнения газового состояния (7.1) получаем
PdV + VdP = RdT.
Но dP = 0 (так как Р = сonst), потому Р dV = R dT. Учитывая это равенство и заменяя dU через Сv dT, из выражения (7.6) получим
Сp = Cv + R. (7.7)
Таким образом Сp > Сv : при нагревании при постоянном давлении тепло, сообщенное газу, идет не только на изменение его внутренней энергии, но и на совершение газом работы.
Важную роль в термодинамике играет величина  . В частности, g входит в уравнение Пуассона, описывающее адиабатический процесс, т.е. процесс, протекающий без теплообмена с окружающей средой (dQ = 0). Уравнение Пуассона в переменных Р,Vимеет вид
. В частности, g входит в уравнение Пуассона, описывающее адиабатический процесс, т.е. процесс, протекающий без теплообмена с окружающей средой (dQ = 0). Уравнение Пуассона в переменных Р,Vимеет вид
РV g = соnst. (7.8)
Из первого начала термодинамики (7.3) для адиабатического процесса следует:
dU +dA = 0,
откуда
dA = - dU = - Cv dT,
т.е. работа в этом случае совершается за счет изменения запаса внутренней энергии.
Описание установки и метода определения Ср / Cv
Для определения  в данной работе используется метод, предложенный немецкими физиками Клеманом и Дезормом.
в данной работе используется метод, предложенный немецкими физиками Клеманом и Дезормом.
|
Установка (рис.7.1) состоит из стеклянного баллона Б емкостью 10 - 15 литров, закрытого пробкой. Через пробку проходят две трубки. Трубка 2 соединена с жидкостным манометром 3, используемым для измерения избыточного по сравнению с атмосферным давления в баллоне. Трубка 1 через кран K1 соединена с атмосферой. Через отверстие в нижней части баллона проходит третья трубка 5, которая через кран K2 соединяет баллон с насосом 4.
Пусть при комнатной температуре Т1 газ, находящийся в баллоне, имеет давление Р1 , которое несколько выше атмосферного Р0. Избыток давления (отсчет h1 ) можно создать насосом при открытом кране K2 и измерить манометром 3 (кран K2 после этого должен быть закрыт), т. е.
Р1 = Р0 + h1 , h1 << Р0
|
Если сейчас на короткое время открыть кран K1 , то будет иметь место процесс адиабатического расширения газа (теплопроводность стенок баллона мала). Давление газа в баллоне при этом сравняется с атмосферным Р0 (рис.7.2), а температура газа понизится до Т2 (работа расширения совершается за счет внутренней энергии газа).
Уравнение Пуассона (7.8), описывающее адиабатический процесс, в нашем случае удобно записать в переменных Р, Т:
 . (7.9)
. (7.9)
После процесса расширения в результате теплообмена температура оставшегося в баллоне газа начинает повышаться. Будет повышаться и давление газа, причем до тех пор, пока температура вновь не сравняется с комнатной. Обозначим это давление через Р2. Очевидно, Р2 =Р0 + h2 , где h2 << P0 - избыточное давление, измеренное по манометру в данном случае. Таким образом, сейчас имеет место изохорный процесс нагревания газа со скоростью, определяемой теплопроводностью стеклянных стенок баллона. Как известно, такой процесс подчиняется закону Гей - Люссака:
 . (7.10)
. (7.10)
Оба процесса (адиабатический, и изохорный ) изображены в координатах Р,V на рис.7.2.
Сравнивая (7.9) и (7.10), можно записать:  .
.
Учитывая, что P1 = P0 + h1 , а Р2 = P0 + h2 , последнее выражение представим как

или
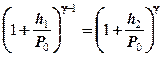 . (7.11)
. (7.11)
Так как h1 и h2 малы по сравнению с Р0 , то обе части равенства (7.11) можно разложить в ряд. Ограничиваясь членами первого порядка, получаем
 ,
,
откуда
 . (7.12)
. (7.12)
Выражение (7.12) является рабочей формулой для определения g. Как видно, для этого достаточно при проведении опытов измерить h1 и h2 .
Дата добавления: 2014-10-31; просмотров: 288; Мы поможем в написании вашей работы!; Нарушение авторских прав |

