
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Из сравнения двух последних выражений следует очень важное для теории растворов соотношение. При всех изменениях состава
 (5.4)
(5.4)
Уравнение (5.4) можно преобразовать, заменив количество молей компонента  на его мольную долю
на его мольную долю 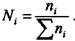 . Для этого нужно
. Для этого нужно
разделить  левую и правую части (5.4) на постоянную величину
левую и правую части (5.4) на постоянную величину  ∑ni:
∑ni:
Дифференцируя последнее выражение по мольной доле какого-либо компонента  , получается ещё одна форма соотношения (5.4)
, получается ещё одна форма соотношения (5.4)

Если в качестве экстенсивного параметра взять изобарно-изотермический потенциал G, то приведённые выше уравнения называются уравнениями Гиббса-Дюгема. Их исключительное значение для теории растворов связано с тем, что молярная
парциальная величина G является химическим потенциалом i-го компонента по определению:

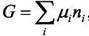
|
Для раствора можно записать
или при бесконечно малом
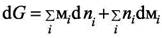
|
| изменении состава |
Совместная запись первого и второго закона термодинамики для открытых систем или фундаментальное уравнение Гиббса для величины dG  имеет вид
имеет вид
Разность последних двух уравнений приводит к одному из важнейших уравнений в теории растворов
 (5.5)
(5.5)
Уравнение (5.5) связывает между собой изменения давления, температуры и химических потенциалов компонентов раствора. При постоянных P и Т формула (5.5) преобразуется в уравнения Гиббса-Дюгема
 5
5
с помощью которых изучают взаимную зависимость химических потенциалов различных компонент раствора.
Дата добавления: 2014-12-23; просмотров: 286; Мы поможем в написании вашей работы!; Нарушение авторских прав |