
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Стабильность фаз
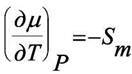
|
Химический потенциал фаз должен быть одинаков, когда система находится в равновесии. Обозначим химические потенциалы твёрдой, жидкой и газообразной фаз как µтв, µж и µг. Зависимость этих потенциалов от температуры при постоянном давлении даётся формулой
(4.7)

|
Так как в однокомпонентной системе µ = Gm , то 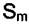 - энтропия одного моля вещества, величина всегда положительная. Можно сразу же сделать вывод, что химический потенциал при повышении температуры уменьшается. Так как
- энтропия одного моля вещества, величина всегда положительная. Можно сразу же сделать вывод, что химический потенциал при повышении температуры уменьшается. Так как  , то градиент
, то градиент
химического потенциала для газа самый большой, он меньше для жидкости и ещё меньше для твёрдого тела. Эти выводы дают возможность нарисовать качественный график (рис. 4.3.) зависимости химического потенциала от температуры для трёх возможных фаз однокомпонентной системы.

Рис. 4.3. Зависимость химического потенциала от температуры в однокомпонентной системе.
График показывает области температур, в которых каждая фаза стабильна. При высоких температурах стабилен газ, но при температуре выше температуры кипения  химический потенциал газа становится выше химического потенциала жидкости, и тогда жидкость более стабильна. При дальнейшем понижении температуры жидкость достигает точки
химический потенциал газа становится выше химического потенциала жидкости, и тогда жидкость более стабильна. При дальнейшем понижении температуры жидкость достигает точки  , где наиболее стабильна твёрдая фаза,
, где наиболее стабильна твёрдая фаза,
и жидкость кристаллизуется. В этой точке  и она называется
и она называется
точкой плавления.Температура при данном давлении, при которой химический потенциал газа равен химическому потенциалу жидкости, называется точкой кипенияпри данном давлении.
С помощью этого рисунка можно показать, что точки кипения и плавления зависят от давления. Химический потенциал зависит от давления следующим образом

|
(4.8)
При повышении давления химический потенциал увеличивается, так как мольный объём  - положительная величина. Это увеличение гораздо больше для газа, чем для жидкости или твёрдого тела. Мольный объём газа примерно в 1000 раз больше мольного объёма жидкости или твёрдого тела. Для большинства веществ (нормальные вещества) мольный объём жидкости больше мольного объёма твёрдого тела, кроме воды, висмута, галлия и некоторых сплавов (аномальные вещества). В этих случаях при увеличении давления химический потенциал жидкости увеличивается несколько больше, чем потенциал твёрдой фазы. Эти изменения показаны на рисунке 4.4. При повышении давления очень заметно повышается точка кипения и наблюдается небольшое повышение точки плавления.
- положительная величина. Это увеличение гораздо больше для газа, чем для жидкости или твёрдого тела. Мольный объём газа примерно в 1000 раз больше мольного объёма жидкости или твёрдого тела. Для большинства веществ (нормальные вещества) мольный объём жидкости больше мольного объёма твёрдого тела, кроме воды, висмута, галлия и некоторых сплавов (аномальные вещества). В этих случаях при увеличении давления химический потенциал жидкости увеличивается несколько больше, чем потенциал твёрдой фазы. Эти изменения показаны на рисунке 4.4. При повышении давления очень заметно повышается точка кипения и наблюдается небольшое повышение точки плавления.

Рис. 4.4. Влияние давления на химический потенциал и точки кипения и плавления вещества.
4.5 Фазовый переход твёрдое тело - жидкость
Плавлению соответствует мольная энтальпия плавления  Кристаллическое твёрдое тело плавится при некоторой температуре Т. Поэтому мольная энтропия плавления равна
Кристаллическое твёрдое тело плавится при некоторой температуре Т. Поэтому мольная энтропия плавления равна  и тогда
и тогда
Дата добавления: 2014-12-23; просмотров: 303; Мы поможем в написании вашей работы!; Нарушение авторских прав |