
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
В приближении идеального газа уравнение Клапейрона -Клаузиуса примет вид

|
В диапазоне температур от тройной точки до НТК можно принять  не зависящей от температуры. Тогда после интегрирования получим
не зависящей от температуры. Тогда после интегрирования получим

|
(4.11)
где  и
и  - параметры некоторой точки на кривой сосуществования жидкость - газ. Уравнение (4.11) даёт довольно простой метод определения теплоты испарения. Надо иметь в виду, что теплота испарения после НТК начинает сильно зависеть от температуры, превращаясь в ноль в критической точке.
- параметры некоторой точки на кривой сосуществования жидкость - газ. Уравнение (4.11) даёт довольно простой метод определения теплоты испарения. Надо иметь в виду, что теплота испарения после НТК начинает сильно зависеть от температуры, превращаясь в ноль в критической точке.
4.8 Примеры фазовых диаграмм
Поведение термодинамической системы можно отобразить с помощью диаграмм, по осям которых откладываются термодинамические параметры или функции состояния. Фазовые диаграммыдают представление о фазовом состоянии вещества. Каждая точка такой диаграммы даёт значения термодинамических параметров и показывает фазовое состояние вещества. Фазы, существующие в равновесии одновременно, называются сосуществующими фазами.Линия, отражающая на фазовой диаграмме состояния сосуществующих фаз, называется кривой фазового равновесия.
4.8.1 Фазовая диаграмма воды. Рис 4.5.
Приведём пример фазовой диаграммы воды в координатах Р-Т. Из-за широкого диапазона давлений, в котором сосуществуют
различные фазы воды  , Р - Т диаграмма
, Р - Т диаграмма
изображена двумя частями и не в масштабе. Вода относится к аномальным веществам, у которых линия сосуществования твёрдое тело - жидкость имеет отрицательный наклон. Твёрдая фаза этих веществ плавает в жидкой, т. е. объём моля твёрдой фазы больше объёма моля жидкости. Температура плавления воды до ~ 2000 атм уменьшается с ростом давления. Температура плавления льда при 1 атм. на 0,01 градуса меньше температуры тройной точки и составляет 273,15 К (0оС). В твёрдом состоянии вода имеет шесть различных кристаллических модификаций льда. Рост давления приводит к изменению связей вода - вода и появлению шести фаз льда. В условиях земной поверхности встречается лишь одна модификация льда (лёд Ι), так как остальные модификации существуют при давлениях выше 2000 атм. На рисунке нет области льда ΥΙΙ, существующего при давлении более 25000 атм и плавящегося при температуре от ~ 360 К и выше. Области льда ΙΥ нет, поскольку последующие эксперименты не подтвердили существование этой фазы, и нумерация льдов является курьёзным отражением этой ошибки.


Рис. 4.5. Р - Т фазовая диаграмма воды. При давлении выше 2000 атм. имеются ещё пять модификации льда.
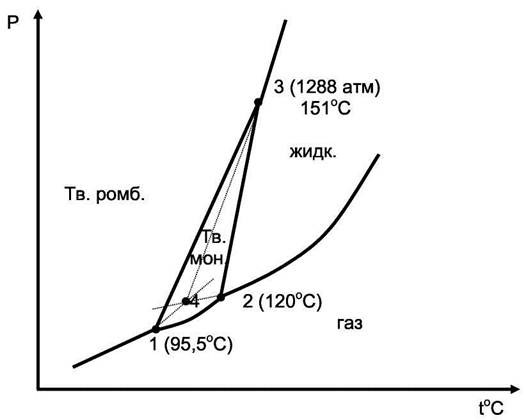
Фазовая диаграмма серы. Рис 4.6.
| Рис 4.6. Фазовая Р - Т диаграмма серы (схема). |
В плоскости Р - Т сплошные линии делят диаграмму на четыре области, соответствующие пару, жидкости и двум кристаллическим модификациям серы. В точках 1, 2 и 3 в равновесии сосуществуют три фазы. Однако из четырёх фаз можно составить четыре сочетания по три, т.е. сера может иметь ещё одну тройную точку. Это точка 4 равновесного сосуществования перегретых кристаллов серы ромбической, переохлаждённой жидкой серы и равновесных с ними паров, пересыщенных относительно серы моноклинической. Подобная система метастабильна. Она состоит из трёх фаз, которые равновесны между собой благодаря равенству их химических потенциалов. Но все эти фазы термодинамически неравновесны, так как при температуре Т4 может существовать ещё одна фаза с более низким химическим потенциалом (сера моноклиническая). Также метастабильными относительно серы моноклинической являются двойные равновесия на линиях 4-1, 4-2 и 4-3.
4.8.3 Фазовая диаграмма углерода. Рис 4. 7. Фазовая диаграмма углерода плохо изучена, поскольку разные фазы становятся стабильными при экстремальных температурах и давлениях. Получение значений равновесных температур и давлений сосуществующих фаз сопровождается труднопреодолимыми экспериментальными проблемами. Газообразный углерод стабилен только при температурах выше 4000 К. Жидкий углерод можно получить примерно при 4500 К и давлениях порядка 1000 атм. Алмазная фаза становится стабильной при давлениях выше 104 атм и температурах до 1000 К. При стандартных условиях стабилен только графит, а алмаз метастабилен. При высоких температурах он легко превращается в графит. При комнатной температуре это превращение идёт с ничтожной скоростью и алмаз сохраняет свою структуру сколь угодно долго. Для получения алмаза недостаточно просто повысить давление графита. Процесс превращения графита в алмаз идёт чрезвычайно медленно. Для промышленного получения алмаза предпочтительнее получить жидкий углерод и охлаждать его при давлении выше давления фазового перехода графит - алмаз. Для ускорения процесса применяются катализаторы.

|
Рис. 4.7. Фазовая Р - Т диаграмма углерода.

|

|
Параметры тройной точки: Т ≈ 4000 К, Р = 105 атм Параметры критической точки: Ткр ≈ 6000 К, Ркр ≈ 6800 атм.
Фазовая диаграмма гелия. Рис. 4.8.
Гелий сжижается при самой низкой температуре среди известных газов. ТНТК гелия равна 4,2 К. При невысоких давлениях гелий остаётся жидким вплоть до 0 К. Твёрдый гелий может существовать при давлениях выше 16 атм. Нормальный жидкий гелий (Не Ι) при охлаждении ниже 2,17 К и давлении меньше атмосферного переходит в новую модификацию. Эта модификация называется Не ΙΙ и обладает сверхтекучестью, т. е. отсутствием вязкости. Точка
перехода Не Ι в Не ΙΙ носит название  -точки. Линия, соединяющая
-точки. Линия, соединяющая
 -точки при разных давлениях называется
-точки при разных давлениях называется  -линией. Особенностью гелия является отсутствие тройной точки. Линии фазового перехода жидкость - газ и твёрдая фаза - жидкость нигде не пересекаются, даже при самых низких температурах, которые могут быть достигнуты
-линией. Особенностью гелия является отсутствие тройной точки. Линии фазового перехода жидкость - газ и твёрдая фаза - жидкость нигде не пересекаются, даже при самых низких температурах, которые могут быть достигнуты
(  ~К)-
~К)-

Рис. 4.8. Фазовая Р - Т диаграмма гелия. Параметры критической точки: 
Дата добавления: 2014-12-23; просмотров: 303; Мы поможем в написании вашей работы!; Нарушение авторских прав |