
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Электролитов
Если реакция

|
осуществляется в неидеальном растворе, то константа равновесия выражается формулой
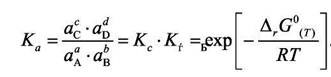
|
Активность "a" растворённого вещества, которое не диссоциирует в данном растворителе, равна произведению концентрации и коэффициента активности
 5
5
где с - молярная концентрация [моль/л].Коэффициент активности при бесконечном разбавлении стремится к единице.
В случае электролита, который практически полностью диссоциирован в растворе, выражение для активности усложняется. Из условия равновесия следует, что химический потенциал практически полностью диссоциированного электролита АХ равен сумме химических потенциалов ионов А+ и Х−:

|
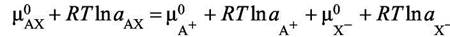
|
(7.19)
| где |

|
| и |

|
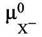
|
- химический потенциал АХ при активности равной единице,
- химические потенциалы катиона и аниона при их
активностях, равных единице.
Активности катиона и аниона можно выразить в виде:

тогда
 (7.20)
(7.20)
где γ± - средний ионный коэффициент активности 1,1 -валентного электролита. Согласно уравнению (7.20)
 (7.21)
(7.21)
Средний ионный коэффициент активности является важной величиной, так как его можно определить экспериментально. Коэффициенты активности отдельных ионов опытным путём получить нельзя. Принимается, что по мере приближения концентрации АХ к нулю средний ионный коэффициент активности стремится к единице, а коэффициент активности АХ в диапазоне концентраций c = 10–5 ÷ 10–1 моль/л можно считать равным единице. В случае молекул, распадающихся на многовалентные ионы, выражение для среднего ионного коэффициента активности усложняется.
Электролиты, молекулы которых распадаются на многовалентные ионы, оказывают большее влияние на ионные коэффициенты активности, чем 1,1-валентные электролиты. Чтобы учесть это влияние, Льюис вместо обычных концентраций ввёл ионную силу J , которая определяется соотношением
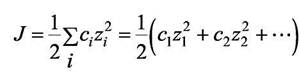
|
(7.22)
где суммирование распространяется на все виды ионов в растворе, а сi -молярная концентрация i-го иона. Большее влияние многозарядного иона учитывается тем, что концентрация умножается на квадрат заряда. Ионная сила 1,1-валентного электролита согласно (7.22) равна его молярной концентрации c.
Коэффициент активности электролита существенно зависит от концентрации. В разбавленных растворах 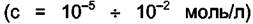 взаимодействие между ионами представляет собой простое кулоновское притяжение или отталкивание. Рассматривая простейшую модель такого взаимодействия, Дебай и Хюккель показали, что в разбавленных растворах коэффициент активности γi иона с зарядом zi выражается формулой
взаимодействие между ионами представляет собой простое кулоновское притяжение или отталкивание. Рассматривая простейшую модель такого взаимодействия, Дебай и Хюккель показали, что в разбавленных растворах коэффициент активности γi иона с зарядом zi выражается формулой


|
Где
Дата добавления: 2014-12-23; просмотров: 313; Мы поможем в написании вашей работы!; Нарушение авторских прав |