
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Щелочами называются растворимые в воде сильные основания.
Рассмотрим еще раз типичные реакции нейтрализации между щелочью и кислотой при помощи структурных формул:

Такая схема наглядно показывает различие между кислотами и основаниями: кислоты склонны отщеплять атомы водорода, а основания – гидрокси-группы. В реакцию нейтрализации с кислотами вступают любые основания, а не обязательно только щелочи.
Разные основания имеют разную способность отщеплять гидрокси-группы, поэтому их, подобно кислотам, подразделяют на сильные и слабые основания (таблица 8-5). Сильные основания в водных растворах склонны легко отдавать свои гидрокси-группы, а слабые – нет.
Таблица 8-5. Классификация оснований по силе.
| Сильные основания | Слабые основания |
| NaOH гидроксид натрия (едкий натр) KOH гидроксид калия (едкое кали) LiOH гидроксид лития Ba(OH)2 гидроксид бария Ca(OH)2 гидроксид кальция (гашеная известь) | Mg(OH)2 гидроксид магния Fe(OH)2 гидроксид железа (II) Zn(OH)2 гидроксид цинка NH4OH гидроксид аммония Fe(OH)3 гидроксид железа (III) и т.д. (большинство гидроксидов металлов) |
** Не следует путать силу основания и его растворимость. Например, гидроксид кальция – сильное основание, хотя его растворимость в воде не велика. В данном случае сильным основанием (щелочью) мы называем ту часть гидроксида кальция, которая растворена в воде.
Сила основания важна в реакциях со слабыми кислотами. Слабое основание и слабая кислота реагируют лишь в незначительной степени. Напротив, сильное основание легче реагирует с любой кислотой независимо от её силы.
| 2 NH4OH | + | H2S | = | (NH4)2S | + | 2 H2O |
| слабое основание | слабая кислота | реакция протекает лишь в незначительной степени (мало продуктов реакции) |
| 2 NaOH | + | H2S | = | Na2S | + | 2 H2O |
| сильноеоснование | слабая кислота | продуктов реакции больше |

 Еще одно важное химическое свойство оснований – способность разлагаться при нагревании на воду и основной оксид.
Еще одно важное химическое свойство оснований – способность разлагаться при нагревании на воду и основной оксид.
Cu(OH)2 = CuO + H2O (при нагревании)
2 Fe(OH)3 = Fe2O3 + 3 H2O (при нагревании)
Растворы щелочей окрашивают индикаторы: лакмус – в синий цвет, фенолфталеин – в малиновый цвет. Индикатор метиловый оранжевый (или метилоранж) в растворах щелочей имеет желтый цвет. Подробнее об индикаторах можно прочитать в следующем параграфе.
3** §8.8 Соли. Получение и химические свойства.
Рассмотрим важнейшие способы получения солей.
1. Реакция нейтрализации. Этот способ уже неоднократно встречался в предыдущих параграфах. Растворы кислоты и основания смешивают (осторожно!) в нужном мольном соотношении. После выпаривания воды получают кристаллическую соль. Например:
| H2SO4 | + | 2 KOH | = | K2SO4 | + | 2 H2O |
| сульфат калия |
 2. Реакция кислот с основными оксидами. Этот способ получения солей упоминался в параграфе 8-3. Фактически, это вариант реакции нейтрализации. Например:
2. Реакция кислот с основными оксидами. Этот способ получения солей упоминался в параграфе 8-3. Фактически, это вариант реакции нейтрализации. Например:
| H2SO4 | + | CuO | = | CuSO4 | + | H2O |
| сульфат меди |
3. Реакция оснований с кислотными оксидами (см. параграф 8.2). Это также вариант реакции нейтрализации:
| Ca(OH)2 | + | CO2 | = | CaCO3↓ | + | H2O |
| карбонат кальция |
 Если пропускать в раствор избыток СО2, то получается избыток угольной кислоты и нерастворимый карбонат кальция превращается в растворимую кислую соль – гидрокарбонат кальция Са(НСО3)2:
Если пропускать в раствор избыток СО2, то получается избыток угольной кислоты и нерастворимый карбонат кальция превращается в растворимую кислую соль – гидрокарбонат кальция Са(НСО3)2:
СаСО3 + Н2СО3 = Са(НСО3)2 (раствор)
4. Реакция основных и кислотных оксидов между собой:
| CaO | + | SO3 | = | CaSO4 |
| сульфат кальция |
 5. Реакция кислот с солями. Этот способ подходит, например, в том случае, если образуется нерастворимая соль, выпадающая в осадок:
5. Реакция кислот с солями. Этот способ подходит, например, в том случае, если образуется нерастворимая соль, выпадающая в осадок:
| H2S | + | CuCl2 | = | CuS↓ (осадок) | + | 2 HCl |
| сульфид меди |
6. Реакция оснований с солями. Для таких реакций подходят только щелочи (растворимые основания). В этих реакциях образуется другое основание и другая соль. Важно, чтобы новое основание не было щелочью и не могло реагировать с образовавшейся солью. Например:
| 3 NaOH | + | FeCl3 | = | Fe(OH)3↓ | + | 3 NaCl |
| (осадок) | хлорид натрия |
 7. Реакция двух различных солей. Реакцию удается провести только в том случае, если хотя бы одна из образующихся солей нерастворима и выпадает в осадок:
7. Реакция двух различных солей. Реакцию удается провести только в том случае, если хотя бы одна из образующихся солей нерастворима и выпадает в осадок:
| AgNO3 | + | KCl | = | AgCl↓ (осадок) | + | KNO3 |
| хлорид серебра | нитрат калия |
Выпавшую в осадок соль отфильтровывают, а оставшийся раствор упаривают и получают другую соль. Если же обе образующиеся соли хорошо растворимы в воде, то реакции не происходит: в растворе существуют лишь ионы, не взаимодействующие между собой:
NaCl + KBr = Na+ + Cl- + K+ + Br-
Если такой раствор упарить, то мы получим смесь солей NaCl, KBr, NaBr и KCl, но чистые соли в таких реакциях получить не удается.
8. Реакция металлов с кислотами. В способах 1 – 7 мы имели дело с реакциями обмена (только способ 4 – реакция соединения. Но соли образуются и в окислительно-восстановительных реакциях. Например, металлы, расположенные левее водорода в ряду активности металлов (таблица 8-3), вытесняют из кислот водород и сами соединяются с ними, образуя соли:
| Fe | + | H2SO4(разб.) | = | FeSO4 | + | H2 |
| сульфат железаII |
 9. Реакция металлов с неметаллами. Эта реакция внешне напоминает горение. Металл "сгорает" в токе неметалла, образуя мельчайшие кристаллы соли, которые выглядят, как белый "дым":
9. Реакция металлов с неметаллами. Эта реакция внешне напоминает горение. Металл "сгорает" в токе неметалла, образуя мельчайшие кристаллы соли, которые выглядят, как белый "дым":
| 2 K | + | Cl2 | = | 2 KCl |
| хлорид калия |
 10. Реакция металлов с солями. Более активные металлы, расположенные в ряду активностилевее, способны вытеснять менее активные (расположенные правее) металлы из их солей:
10. Реакция металлов с солями. Более активные металлы, расположенные в ряду активностилевее, способны вытеснять менее активные (расположенные правее) металлы из их солей:
| Zn | + | CuSO4 | = | Cu | + | ZnSO4 |
| порошок меди | сульфат цинка |
Теперь рассмотрим химические свойства солей.
Наиболее распространенные реакции солей – реакции обмена и окислительно-восстановительные реакции. Сначала рассмотрим примеры окислительно-восстановительных реакций.
1. Окислительно-восстановительные реакции солей.
Поскольку соли состоят из ионов металла и кислотного остатка, их окислительно-восстановительные реакции условно можно разбить на две группы: реакции за счет иона металла и реакции за счет кислотного остатка, если в этом кислотном остатке какой-либо атом способен менять степень окисления.
а) Реакции за счет иона металла.
Поскольку в солях содержится ион металла в положительной степени окисления, они могут участвовать в окислительно-восстановительных реакциях, где ион металла играет роль окислителя. Восстановителем чаще всего служит какой-нибудь другой (более активный) металл. Приведем пример:
| Hg2+SO4 | + | Sn0 | = | Hg0 | + | Sn2+SO4 |
| соль менее активного металла (окислитель) | более активный металл (восстановитель) |
Принято говорить, что более активные металлы способны вытеснять другие металлы из их солей. Металлы, находящиеся в ряду активности левее , являются более активными. Нетрудно заметить, что это те же реакции металлов с солями (см. пункт 10 предыдущего раздела).
б) Реакции за счет кислотного остатка.
В кислотных остатках часто имеются атомы, способные изменять степень окисления. Отсюда –многочисленные окислительно-восстановительные реакции солей с такими кислотными остатками. Например:
| Na2S–2 | + | Br20 | = | S0 | + | 2 NaBr–1 |
| соль сероводородной кислоты | сера |
| 2 KI–1 | + | H2O2–1 | + | H2SO4 | = | I20 | + | K2SO4 | + | 2 H2O–2 |
| соль иодоводородной кислоты | иод |
| 2 KMn+7O4 | + | 16 HCl–1 | = | 5 Cl20 | + | 2 KCl | + | 2 Mn+2Cl2 | + | 8 H2O |
| соль марганцовой кислоты | хлорид марганца |
| 2 Pb(N+5O3–2)2 | = | 2 PbO | + | 4 N+4O2 | + | O20 |
| соль азотной кислоты | при нагревании |
2. Обменные реакции солей.
Такие реакции могут происходить в растворах, когда соли реагируют: а) с кислотами, б) с щелочами, в) с другими солями. Например:
а) CuSO4 + H2S = CuS↓ (осадок) + H2SO4
AgNO3 + HCl = AgCl↓ (осадок) + HNO3
б) FeCl3 + 3 NaOH = Fe(OH)3↓ (осадок) + 3 NaCl
CuSO4 + 2 KOH = Cu(OH)2↓ (осадок) + K2SO4
в) BaCl2 + K2SO4 = BaSO4↓ (осадок) + 2 KCl
CaCl2 + Na2CO3 = CaCO3↓ (осадок) + 2 NaCl
Некоторые из этих реакций уже встречались в опытах из первой части параграфа.
Во всех случаях один из продуктов обменной реакции обязательно должен покидать реакционную смесь в виде осадка или газообразного вещества. Либо должно получаться прочное соединение, не распадающееся в растворе на ионы (например, вода в реакции нейтрализации). Если эти условия не выполняется, то при смешивании реагентов в лучшем случае образуется смесь не реагирующих между собой ионов - реакция не идет.
4А́том (др. -греч. ἄτομος — неделимый) — наименьшая часть химического элемента, являющаяся носителем его свойств. Термин был введён ещё в V веке до н. э. Демокритом, основывавшемся на абстрактных размышлениях: «Сладость и горькость, жара и холод суть определения, на самом же деле [есть только] атомы и пустота» . В XIX веке умозрительная теория получила научное подтверждение. Однако в современном представлении атом является сложным, делимым телом, а в буквальном смысле как «неделимые» , точнее фундаментальные частицы, рассматриваются кварки, лептоны и калибровочные бозоны.
Современное представление об атоме
Сегодня общепринятой является модель атома, являющаяся развитием планетарной модели. Считается, что ядро атома состоит из положительно заряженных протонов и не имеющих заряда нейтронов и окружено отрицательно заряженными электронами. Однако представления квантовой механики не позволяют считать, что электроны движутся вокруг ядра по сколько-нибудь определённым траекториям (неопределённость координаты электрона в атоме может быть сравнима с размерами самого атома) .
Химические свойства атомов определяются конфигурацией электронной оболочки и описываются квантовой механикой. Позиция атома в таблице Менделеева определяется количеством протонов, в то время как количество нейтронов на химические свойства практически не влияет; при этом нейтронов в ядре, как правило, больше, чем протонов (см. статью об атомном ядре) . Количество электронов в нейтральном состоянии по определению соответствует количеству протонов. Основная масса атома сосредоточена в ядре, в то время как массовая доля электронов в общей массе атома незначительна (несколько сотых процента массы ядра) .
Массу атома принято измерять в атомных единицах массы, равных 1/12 от массы атома изотопа углерода 12C.
Модели атомов
Кусочки материи. Демокрит полагал, что свойства того или иного вещества определяются формой, массой, пр. характеристиками образующих его атомов. Так, скажем, у огня атомы остры, поэтому огонь способен обжигать, у твёрдых тел они шероховаты, поэтому накрепко сцепляются друг с дружкой, у воды — гладки, поэтому она способна течь. Даже душа человека, согласно Демокриту, состоит из атомов.
«Пудинг с изюминками» (модель Томсона) . Дж. Дж. Томсон предложил рассматривать атом как некоторое положительно заряженное тело с заключёнными внутри него электронами. Эта модель не объясняет сериальный характер излучения атома.
Атом, типа Сатурна. 1904 год. Хентара Нагаока. Маленькое положительное ядро, вокруг которого, по орбиталям, вращаются электроны.
Планетарная модель атома. 1911 год. Эрнест Резерфорд, проделав ряд экспериментов, пришёл к выводу, что атом представляет собой скорее некоторое подобие планетной системы, то есть что электроны движутся вокруг положительно заряженного тяжёлого ядра, расположенного в центре атома. Однако такое описание атома вошло в противоречие с классической электродинамикой. Дело в том, что, согласно классической электродинамике, заряд, движущийся по окружности, должен излучать электромагнитные волны, а следовательно, терять энергию. Расчеты показывали, что время, за которое электрон в таком атоме упадёт на ядро, совершенно ничтожно. Для объяснения стабильности атомов Нильсу Бору пришлось ввести постулаты, которые сводились к тому, что электрон в атоме, находясь в некоторых специальных энергетических состояниях, не излучает. Постулаты Бора показали, что для описания атома классическая механика неприменима. Дальнейшее изучение излучения атома привело к созданию квантовой механики, которая позволила объяснить подавляющее большинство наблюдаемых фактов.
5Атомное ядро состоит из нуклонов — положительно заряженных протонов и нейтральныхнейтронов, которые связаны между собой при помощи сильного взаимодействия. Протон и нейтрон обладают собственным моментом количества движения (спином), равным  [сн 1] и связанным с ним магнитным моментом. Единственный стабильный атом, не содержащий нейтрон в ядре — лёгкий водород (протий). Единственный нестабильный атом без нейтронов - Гелий-2 (дипротон).[1]
[сн 1] и связанным с ним магнитным моментом. Единственный стабильный атом, не содержащий нейтрон в ядре — лёгкий водород (протий). Единственный нестабильный атом без нейтронов - Гелий-2 (дипротон).[1]
Атомное ядро, рассматриваемое как класс частиц с определённым числом протонов и нейтронов, принято называть нуклидом.
В некоторых редких случаях могут образовываться короткоживущие экзотические атомы у которых вместо нуклона ядром служат иные частицы.
Количество протонов в ядре называется его зарядовым числом  — это число равно порядковому номеру элемента, к которому относится атом, в таблице (Периодической системе элементов) Менделеева. Количество протонов в ядре определяет структуруэлектронной оболочки нейтрального атома и, таким образом, химические свойствасоответствующего элемента. Количество нейтронов в ядре называется его изотопическим числом
— это число равно порядковому номеру элемента, к которому относится атом, в таблице (Периодической системе элементов) Менделеева. Количество протонов в ядре определяет структуруэлектронной оболочки нейтрального атома и, таким образом, химические свойствасоответствующего элемента. Количество нейтронов в ядре называется его изотопическим числом  . Ядра с одинаковым числом протонов и разным числом нейтронов называютсяизотопами. Ядра с одинаковым числом нейтронов, но разным числом протонов — называются изотонами. Термины изотоп и изотон используются также применительно к атомам, содержащим указанные ядра, а также для характеристики нехимических разновидностей одного химического элемента. Полное количество нуклонов в ядре называется его массовым числом
. Ядра с одинаковым числом протонов и разным числом нейтронов называютсяизотопами. Ядра с одинаковым числом нейтронов, но разным числом протонов — называются изотонами. Термины изотоп и изотон используются также применительно к атомам, содержащим указанные ядра, а также для характеристики нехимических разновидностей одного химического элемента. Полное количество нуклонов в ядре называется его массовым числом 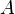 (
(  ) и приблизительно равно средней массе атома, указанной в таблице Менделеева. Нуклиды с одинаковым массовым числом, но разным протон-нейтронным составом принято называтьизобарами.
) и приблизительно равно средней массе атома, указанной в таблице Менделеева. Нуклиды с одинаковым массовым числом, но разным протон-нейтронным составом принято называтьизобарами.
5-1Изото́пы (от др.-греч. ισος — «равный», «одинаковый», и τόπος — «место») — разновидности атомов (и ядер) какого-либо химического элемента, которые имеют одинаковый атомный (порядковый) номер, но при этом разные массовые числа. Название связано с тем, что все изотопы одного атома помещаются в одно и то же место (в одну клетку) таблицы Менделеева. Химические свойства атома зависят от строения электронной оболочки, которая, в свою очередь, определяется в основном зарядом ядра Z(то есть количеством протонов в нём), и почти не зависят от его массового числа A (то есть суммарного числа протонов Z и нейтронов N). Все изотопы одного элемента имеют одинаковый заряд ядра, отличаясь лишь числом нейтронов. Обычно изотоп обозначается символом химического элемента, к которому он относится, с добавлением верхнего левого индекса, означающего массовое число (например, 12C, 222Rn). Можно также написать название элемента с добавлением через дефис массового числа (например, углерод-12, радон-222). Некоторые изотопы имеют традиционные собственные названия (например,дейтерий, актинон).
5-2Изоба́ры (в ед.ч. изоба́р; др.-греч. ἴσος (isos) — «одинаковый» + βάρος (baros) — «вес») — нуклиды разных элементов, имеющие одинаковое массовое число; например, изобарами являются 40Ar, 40K, 40Ca.
Описание[править | править вики-текст]
Хотя массовое число (т. е. число нуклонов) A = N + Z в ядрах-изобарах одинаково, числа протонов Z и нейтронов Nразличаются:  ,
,  . Совокупность нуклидов с одинаковым A, но разным Z называют изобарической цепочкой. В то время как массовое число изобаров одинаково, их атомные массы совпадают лишь приближённо. Зависимость атомной массы (или избытка массы) от Z в изобарической цепочке показывает направление возможныхбета-распадов. Эта зависимость в первом приближении представляет собой параболу (см. формула Вайцзеккера) — сечение долины стабильности плоскостью A = const.
. Совокупность нуклидов с одинаковым A, но разным Z называют изобарической цепочкой. В то время как массовое число изобаров одинаково, их атомные массы совпадают лишь приближённо. Зависимость атомной массы (или избытка массы) от Z в изобарической цепочке показывает направление возможныхбета-распадов. Эта зависимость в первом приближении представляет собой параболу (см. формула Вайцзеккера) — сечение долины стабильности плоскостью A = const.
Те виды радиоактивного распада, которые не изменяют массовое число (бета-распад, двойной бета-распад,изомерный переход), переводят одно ядро-изобар в другое. Поскольку распады такого рода происходят в направлении уменьшения избытка массы, последовательность таких распадов заканчивается на ядре, представляющем энергетический минимум в данной изобарической цепочке (бета-стабильное ядро). Для ядер с чётным массовым числом таких локальных минимумов на изобарической цепочке может быть от 1 до 3, поскольку чётно-чётные ядра (Z и N чётны) благодаря энергии спаривания имеют бо́льшую энергию связи, чем нечётно-нечётные ядра с тем же массовым числом. Локальные минимумы отличаются зарядом ядра на 2 единицы (  ), поэтому прямые бета-переходы между основными состояниями таких ядер невозможны (бета-распад изменяет заряд ядра на единицу). Переходы из локальных минимумов цепочки в глобальный возможны лишь благодаря двойным бета-процессам, которые являются процессами второго порядка по константе связи слабого взаимодействия и поэтому сильно подавлены: периоды полураспада превышают 1019 лет. Таким образом, для нечётных A существует один бета-стабильный изобар, для чётных A — от одного до трёх. Если альфа-распад (и другие виды распада, изменяющие массовое число) для бета-стабильного изотопа запрещён или сильно подавлен, то этот изотоп присутствует в природной смеси изотопов.
), поэтому прямые бета-переходы между основными состояниями таких ядер невозможны (бета-распад изменяет заряд ядра на единицу). Переходы из локальных минимумов цепочки в глобальный возможны лишь благодаря двойным бета-процессам, которые являются процессами второго порядка по константе связи слабого взаимодействия и поэтому сильно подавлены: периоды полураспада превышают 1019 лет. Таким образом, для нечётных A существует один бета-стабильный изобар, для чётных A — от одного до трёх. Если альфа-распад (и другие виды распада, изменяющие массовое число) для бета-стабильного изотопа запрещён или сильно подавлен, то этот изотоп присутствует в природной смеси изотопов.
В масс-спектрометрии изобарами называются как ядра с одинаковым массовым числом, так и молекулы с (приблизительно) одинаковой молекулярной массой. Так, молекулы 16O1H2H (полутяжёлой воды) являются молекулярными изобарами к атому 19F. Ионы таких молекул и атомов имеют почти одинаковое отношение масса/заряд (при равном заряде) и, следовательно, движутся в электромагнитных полях масс-спектрометра по почти одинаковой траектории, являясь источником фона для своих изобар.
Для изобаров справедливо правило Щукарева — Маттауха, объясняющее, в частности, отсутствие стабильных изотопов у технеция[1].
6Квант (от лат. quantum — «сколько») — неделимая порция какой-либо величины в физике. В основе понятия лежит представление квантовой механики о том, что некоторые физические величины могут принимать только определённые значения (говорят, что физическая величина квантуется). В некоторых важных частных случаях эта величина или шаг её изменения могут быть только целыми кратными некоторого фундаментального значения[1] — и последнее называют квантом. Например, энергия монохроматического электромагнитного излучения угловой частоты  может принимать значения
может принимать значения  , где
, где  — редуцированная постоянная Планка, а
— редуцированная постоянная Планка, а  — целое число. В этом случае
— целое число. В этом случае  имеет смысл энергии кванта излучения (иными словами, фотона), а
имеет смысл энергии кванта излучения (иными словами, фотона), а  — смысл числа́ этих квантов (фотонов). В смысле, близком к этому, термин квант был впервые введен Максом Планком в его классической работе 1900 года — первой работе по квантовой теории, заложившей её основу. Вокруг идеи квантования с начала 1900-х годов развилась полностью новая физическая концепция, обычно называемая квантовой физикой.
— смысл числа́ этих квантов (фотонов). В смысле, близком к этому, термин квант был впервые введен Максом Планком в его классической работе 1900 года — первой работе по квантовой теории, заложившей её основу. Вокруг идеи квантования с начала 1900-х годов развилась полностью новая физическая концепция, обычно называемая квантовой физикой.
Ныне прилагательное «квантовый» используется в названии ряда областей физики (квантовая механика, квантовая теория поля, квантовая оптика и т. д.). Широко применяется термин квантование, означающий построение квантовой теории некоторой системы или переход от её классического описания к квантовому. Тот же термин употребляется для обозначения ситуации, в которой физическая величина может принимать только дискретные значения — например, говорят, что энергия электрона в атоме «квантуется».
Бо́ровская моде́ль а́тома (Моде́ль Бо́ра) — полуклассическая модельатома, предложенная Нильсом Бором в 1913 г. За основу он взял планетарную модель атома, выдвинутую Резерфордом. Однако, с точки зрения классической электродинамики, электрон в модели Резерфорда, двигаясь вокруг ядра, должен был бы излучать энергию непрерывно и очень быстро и, потеряв её, упасть на ядро. Чтобы преодолеть эту проблему, Бор ввёл допущение, суть которого заключается в том, что электроны в атоме могут двигаться только по определённым (стационарным) орбитам, находясь на которых они не излучают, а излучение или поглощение происходит только в момент перехода с одной орбиты на другую. Причём, стационарными являются лишь те орбиты, при движении по которым момент количества движения электрона равен целому числу постоянных Планка[1]:  .
.
7Ква́нтовая меха́ника — раздел теоретической физики, описывающий физические явления, в которых действие сравнимо по величине с постоянной Планка. Предсказания квантовой механики могут существенно отличаться от предсказаний классической механики. Поскольку постоянная Планка является чрезвычайно малой величиной по сравнению с действием макроскопических объектов, квантовые эффекты в основном проявляются в микроскопических масштабах. Если физическое действие системы намного больше постоянной Планка, квантовая механика органически переходит в классическую механику. В свою очередь, квантовая механика является нерелятивистским приближением (то есть приближением малых энергий по сравнению с энергией покоя массивных частиц системы)квантовой теории поля.
Классическая механика, хорошо описывающая системы макроскопических масштабов, не способна описать все явления на уровне молекул, атомов, электронов и фотонов. Квантовая механика адекватно описывает основные свойства и поведение атомов, ионов, молекул, конденсированных сред, и других систем с электронно-ядерным строением. Квантовая механика также способна описывать поведение электронов, фотонов, а также других элементарных частиц, однако более точное релятивистски инвариантное описание превращений элементарных частиц строится в рамках квантовой теории поля. Эксперименты подтверждают результаты, полученные с помощью квантовой механики.
Основными понятиями квантовой кинематики являются понятия наблюдаемой исостояния.
8Ква́нтовое число́ в квантовой механике — численное значение какой-либо квантованной переменной микроскопического объекта (элементарной частицы, ядра, атома и т. д.), характеризующее состояние частицы. Задание квантовых чисел полностью характеризует состояние частицы.
Некоторые квантовые числа связаны с движением в пространстве и характеризуют вид волновой функции частицы. Это, например, радиальное (главное) (  ), орбитальное (
), орбитальное (  ), магнитное (
), магнитное (  ) и спиновое число квантовые числа электрона в атоме, которые определяются как число узлов радиальной волновой функции, значение орбитального углового момента, его проекция на заданную ось и спин частицы, соответственно.
) и спиновое число квантовые числа электрона в атоме, которые определяются как число узлов радиальной волновой функции, значение орбитального углового момента, его проекция на заданную ось и спин частицы, соответственно.
Некоторые другие квантовые числа никак не связаны с перемещением в обычном пространстве, а отражают «внутреннее» состояние частицы. К таким квантовым числам относится спин и его проекция. В ядерной физикевводится также изоспин, а в физике элементарных частиц появляется цвет, очарование, прелесть (или красота[1]) иистинность.
93.1.3 Электронная структура атомов и периодическая система элементов
При l=0, т.е. на s-подуровне *, имеется всего одна орбиталь *, которую принято изображать в виде клетки. В атоме Нединственный электрон находится на самом низком из возможных энергетических состояний, т.е. на s-подуровне первого электронного слоя (на 1s-подуровне). Электронную структуру атома Н можно представить схемой:

В атоме гелия, порядковый номер которого в периодической системе * (или заряд ядра Z) равен 2, второй электрон тоже находится в состоянии 1s. Электронная структура атома гелия:

У этого атома завершается заполнение ближайшего к ядру K-слоя и тем самым завершается построение первого периода системы элементов.
Рассмотренные для атомов H и He способы описания электронных оболочек называются электронно-графическими формулами (орбитали изображаются в виде клеток) и электронными формулами (подуровни обозначаются буквами, а количество электронов на них указано верхним индексом).
У следующего за гелием элемента лития (Z=3) третий электрон уже не может разместиться на орбитали K-слоя: это противоречило бы принципу Паули *. Поэтому он занимает s-состояние второго энергетического уровня (L-слой, n=2). Его электронная структура записывается формулой 1s22s1, что соответствует схеме:
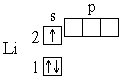
Далее формирование электронных оболочек у элементов 2-го периода происходит следующим образом:

Для атома углерода уже можно предположить три возможных схемы заполнения электронных оболочек в соответствии с электронно-графическими формулами:

Анализ атомного спектра показывает, что правильна последняя схема. Такой порядок размещения электронов в атоме углерода представляет собой частный случай общей закономерности, выражаемой правилом Хунда: устойчивому состоянию атома соответствует такое распределение электронов в пределах энергетического подуровня, при котором абсолютное значение суммарногоспина атома максимально. Пользуясь правилом Хунда, нетрудно составить схему электронного строения для атома азота (Z=7):

Этой схеме соответствует формула 1s22s22p3. Затем начинается попарное размещение электронов на 2p-орбиталях. Электронные формулы остальных атомов второго периода:
O 1s22s22p4 F 1s22s22p5 Ne 1s22s22p6
У атома неона заканчивается заполнение второго энергетического уровня, и завершается построение второго периода системы элементов.
Третий период, подобно второму, начинается с двух элементов (Na, Mg), у которых электроны размещаются на s-подуровне внешнего электронного слоя. Такие элементы называются s-элементами (т.е. они относятся к s-семейству элементов). Затем следуют шесть элементов (от Al до Ar), у которых происходит формирование p-подуровня внешнего электронного слоя. Это атомы p-элементов (принадлежат к p-семейству). Структура внешнего электронного слоя соответствующих элементов второго и третьего периодов оказывается аналогичной. Иначе говоря, с увеличением заряда ядра электронная структура внешних слоев атомов периодически повторяется. Однако электронное строение атомов определяет свойства элементов и их соединений. В этом состоит сущностьпериодического закона: свойства элементов и образуемых ими простых и сложных веществ находятся в периодической зависимости от заряда ядра.
У атома аргона остаются незанятыми все орбитали 3d-подуровня. Однако у следующих за аргоном элементов – калия и кальция – заполнение 3-го электронного слоя временно прекращается, и начинает формироваться s-подуровень 4-го слоя. Такой порядок заполнения вытекает из первого правила Клечковского: при увеличении заряда ядра атомов заполнение энергетических уровней происходит оторбиталей с меньшим значением суммы главного * и орбитального * квантовых чисел (n+l) к орбиталям с большим значением этой суммы. Следовательно, 4s-подуровень (n+l=4) должен заполняться раньше, чем 3d (n+l=5). Для атома скандия возникает вопрос: какой из подуровней должен заполняться – 3d или 4p, т.к. сумма n+l для них одинакова и равна 5. В подобных случаях порядок заполнения определяется вторым правилом Клечковского, согласно которому при одинаковых значениях суммы (n+l) орбитали заполняются в порядке возрастания главного квантового числа n. Заполнение 3d-подуровня происходит у десяти элементов от Sc до Zn. Это атомы d-элементов. Затем начинается формирование 4p-подуровня (p-элементы от Ga до Kr). Как и атомы предшествующих благородных газов – неона и аргона – атом криптона характеризуется структурой внешнего электронного слоя ns2np6.
Аналогично формируется пятый период.
В шестом периоде после заполнения 6s-подуровня начинается заполнение 4f-подуровня, и следуют атомы f-элементов. В связи с тем, что у них внешним является шестой уровень, а электроны последовательно занимают 4-й уровень, лежащий гораздо ближе к ядру, то химические свойства всех этих f-элементов близки к лантану, поэтому их часто называют лантаноидами (в 7-м периоде f-элементы называются актиноидами). После 4f заполняется 5d и, наконец, 6p-подуровень, заполнением которого заканчивается построение шестого периода. Седьмой период не завершен, т.к. элементы с большим зарядом ядра оказываются очень неустойчивыми (легко протекаютядерные реакции).
Порядок заполнения подуровней в соответствии с правилами Клечковского можно записать в виде последовательности: 1s → 2s→ 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p. Однако для некоторых элементов эта последовательность нарушается, т.е. из правил Клечковского имеются исключения. У атомов Cr, Cu, Nb, Mo, Ru, Rh, Pd, Ag, Pt, Au имеет место “провал” электрона с s-подуровня внешнего слоя на d-подуровень предыдущего слоя, что приводит к энергетически более устойчивому состоянию атома. Например, электронная формула атома меди имеет вид: Cu 1s2 2s2 2p6 3s2 3p6 3d10 4s1, т.е. один из двух 4s-электронов “проваливается” на 3d-подуровень. Особо следует отметить палладий, у которого “проваливаются” два электрона: Pd 1s2 2s22p6 3s2 3p6 4s2 4p6 4d10 5s0. Второй тип исключений из правила Клечковского состоит в том, что перед заполнением 4f-подуровня один электрон располагается на 5d-подуровне: La 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f0 5s2 5p6 5d1 6s2. У следующего элемента (церия) 5d-подуровень освобождается, и оба электрона располагаются на 4f-подуровне: Ce 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f2 5s2 5p6 5d0 6s2. Аналогично, в 7-м периоде у актиния последний из электронов располагается на 6d-подуровне (а не на 5f, как должно быть по правиламКлечковского).
Структура периодической системы элементов Д.И. Менделеева. Периодическая система состоит из периодов и групп. Порядковый номер элемента в периодической системе равен заряду ядра, или количеству протонов в нем, а также количеству электронов в оболочке нейтрального атома.
Период – последовательный ряд элементов, атомы которых различаются числом электронов в наружном слое. Каждый период начинается типичным металлом и завершается благородным газом. Номер периода совпадает со значением главного квантового числа *внешнего электронного уровня.
Принадлежность элементов к группам и деление их на подгруппы зависит от структуры двух внешних слоев. В соответствии с количеством электронов в этих слоях элементы периодической системы разделены на 8 групп. Номер группы совпадает с числомвалентных электронов элемента. Валентными являются в первую очередь ns- и np-электроны (n – номер внешнего электронного слоя), а затем (n–1)d-электроны. Для примера рассмотрим электронные формулы хлора и марганца.
Cl 1s22s22p63s23p5 Mn 1s22s22p63s23p63d54s2
Здесь подчеркнуты валентные электроны, количество которых в обоих случаях равно 7. В соответствии с этим Cl и Mn находятся в VII группе периодической системы. В каждой группе главную подгруппу образуют атомы s- и p-элементов, а побочную – атомы d- и f-элементов.
Дата добавления: 2014-12-30; просмотров: 420; Мы поможем в написании вашей работы!; Нарушение авторских прав |