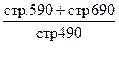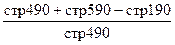КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
А не могут.
| Коэффициент | Что показывает | Как рассчитывается | Комментарий | ||
| 1. Коэффициент автономии | Характеризует финансовую независимость организации от заемных средств. Показывает долю собственных средств в общей сумме всех средств организации |
| Минимальные пороговые значения на уровне 0,5. Превышение указывает на увеличение финансовой независимости, расширение возможности привлечения средств со стороны. | ||
| 2. Коэффициент соотношения заемных и собственных средств. | Сколько заемных средств привлекла организация на 1 рубль собственных средств |
 Заемные ср-ва Заемные ср-ваСобственные средства
| Кз/с <0,7 Превышение указанной границы означает зависимость системы от внешних источников средств, потерю финансовой устойчивости и автономности. | ||
| 3. Коэффициент обеспеченности собственными оборотными средствами. | Наличие собственных оборотных средств (СОС), необходимых для его финансовой устойчивости. Критерий для опреде-ления платежеспособности организации. |
средства
| Косос ≥0,1 Чем выше показатель, тем лучше финансовое состояние предприятия, тем больше у него возможностей проведения независимой финансовой политики. | ||
| 4. Коэффициент маневренности. | Способность органи-зации поддерживать уровень собственного оборотного капитала и пополнять оборот-ные средства за счет собственных источни-ков. |

Собственные средства
| К.м=0,2-0,5 Чем ближе значение показателя к верхней границе, тем больше возможность финансового маневра. | ||
| 5. Коэффициент соотношения мобильных и иммобилизованных средств. |
|
Оборотные
 средства Внеоборотные
средства средства Внеоборотные
средства

| Чем выше значение показателя, тем больше средств предприятие вкладывает в оборотные активы. | ||
| 6. Коэффициент имущества производственного назначения. |
|
 ВА+ПЗ Валюта баланса ВА+ПЗ Валюта баланса
 ВА – внеоборотные активы;
ПЗ – производственные запасы
ВА – внеоборотные активы;
ПЗ – производственные запасы
| Кипн≥0,5 При снижении показателя ниже рекомендуемого значения целесообразно привлечение долгосрочных заемных средств для увеличения имущества производственного значения. | ||
| 7. Коэффициент прогноза банкротства | Показывает долю чистых оборотных активов в стоимости всех средств органи-зации. |
 ОА-КП ОА-КПВалюта баланса
ОА – оборотные активы КП – краткосрочные пассивы | Снижения показателя свидетельствует о финансовых затруднениях |
А HCl
4 Укажите формулу сильной кислоты.
D H2SO4;
5 С каким из перечисленных веществ будет реагировать BeO
В NaOH
6 С каким из перечисленных веществ будет реагировать SiO2
А NaOH
7 Укажите формулу щелочи.
В NaOH;
8 Укажите формулу поваренной соли.
В NaCl;
9 С каким из приведённых веществ будет взаимодействовать СО2.
D NaOH;
10 С каким из приведённых веществ будет взаимодействовать К2О.
А SO3;
11 С каким из приведённых веществ будет взаимодействовать НСl.
С NaOH;
12 С каким из приведённых веществ будет взаимодействовать NаОН.
E HCl.
13 Укажите амфотерный гидроксид.
В Al(OH)3;
14 Укажите амфотерный оксид.
С ZnO;
15 С каким из перечисленных веществ будет реагировать Al(OH)3
C HCl
16 С каким из перечисленных веществ будет реагировать Al(OH)3
C NaOH
17 Укажите формулу основной соли
В CuOHCl;
18 Укажите формулу кислой соли
E CaHPO4
19 С каким из приведённых веществ будет взаимодействовать MgО.
А CO2;
20 С каким из приведённых веществ будет взаимодействовать P2O5.
D Na2O;
21 Укажите формулу средней соли
E K3PO4
22 Укажите формулу сильной кислоты.
D HNO3;
23 С каким из приведённых веществ будет взаимодействовать NаОН.
В FeCl3;
24 Укажите формулу ортофосфата кальция
B Ca3(PO4)2
25 С каким из приведённых веществ будет взаимодействовать НNO3.
С NaOH;
ТЕМА 2 Закон эквивалентов
1 Определите фактор эквивалентности средней соли Al2(SO4)3 (моль):
D 1/6;
2 Определите фактор эквивалентности кислоты H2S (моль):
А 1/2;
3 Определите фактор эквивалентности основания Al(OH)3 (моль):
E 1/3
4 Определите фактор эквивалентности оксида Fe2O3 (моль):
B 1/6
5 Определите фактор эквивалентности кислой соли NaHSO4 (моль):
B 1
6 Определите фактор эквивалентности оксида Na2O (моль):
D 1/2
7 Определите фактор эквивалентности средней соли Na2SiO3 (моль):
A 1/2
8 Определите фактор эквивалентности кислоты H2Cr2O7 (моль):
D 1/2
9 Определите фактор эквивалентности кислой соли NaH2PO4 в уравнении реакции (моль):
NaH2PO4 + NaOH= Na2HPO4 + H2O
D 1
10 Определите фактор эквивалентности основания Fe(OH)3 (моль):
D 1/3
11 Определите фактор эквивалентности кислоты в уравнении реакции, (моль):
H3PO4 + 2NaOH = Na2HPO4 + H2O
A 1/2
12 Определите фактор эквивалентности основания в уравнении реакции, (моль):
2HCl + Аl(OH)3 = Al OHCl2 + 2H2O
E 1/2
13 Определите фактор эквивалентности оксида магния по уравнению реакции (моль):
MgO +2HCl=MgCl2+H2
A 1
14 Определите фактор эквивалентности средней соли Fe2(SO4)3 (моль):
C 1/6
15 Определите фактор эквивалентности СоСl2 по уравнению реакции (моль):
СоСl2+ NaOH= СоOHСl +NaCl
A 1
16 Определите фактор эквивалентности оксида MnO2 (моль):
D 1/2
17 Определите фактор эквивалентности оксида NO (моль):
D 1/2
18 Определите фактор эквивалентности средней соли Na2SO3 (моль):
A 1/2
19 Определите фактор эквивалентности основания в уравнении реакции, (моль):
HCl + Аl(OH)3 = Al(OH)2Cl + H2O
C 1
20 Определите фактор эквивалентности оксида Al2O3 (моль):
B 1/6
21 Определите фактор эквивалентности кислоты в уравнении реакции, (моль):
H2SO4 + NaOH = NaHSO4 + H2O
E 1
22 Определите фактор эквивалентности кислоты в уравнении реакции, (моль):
H2SO4 + 2NaOH = Na2SO4 + 2H2O
C 1/2
23 Определите фактор эквивалентности основания в уравнении реакции, (моль):
HCl + Cu(OH)2 = CuOHCl + H2O
C 1
24 Определите фактор эквивалентности основания в уравнении реакции, (моль):
3HCl + Аl(OH)3 = AlCl3 + 3H2O
A 1/3
25 Определите фактор эквивалентности основания Sr(OH)2 (моль):
D 1/2
Тема 3 Закон сохранения массы веществ в химических реакциях
1 Докажите на основании следующего уравнения закон сохранения массы веществ
NaOH + H2SO4 NaHSO4 + H2O
Е 138
2 Докажите на основании следующего уравнения закон сохранения массы веществ
CO2 + Ca(OH)2 Ca(HCO3)2
D 162
3 Докажите на основании следующего уравнения закон сохранения массы веществ
Zn + 2HCl H2 + ZnCl2
D 138
4 Докажите на основании следующего уравнения закон сохранения массы веществ
Al2O3 + 3H2SO4 Al2(SO4)3 + 3H2O
А 396
5 Докажите на основании следующего уравнения закон сохранения массы веществ
P2O5 + 3Ca(OH)2 3H2O + Ca3(PO4)2 нет пр. (382)
D 364
6 Докажите на основании следующего уравнения закон сохранения массы веществ
Cu(OH)2 + 2HCl CuCl2+ 2H2O
D 171
7 Докажите на основании следующего уравнения закон сохранения массы веществ
AlOHCl2 + HCl AlCl3 + H2O
Е 151,5
8 Докажите на основании следующего уравнения закон сохранения массы веществ
SO3 + 2NaOH Na2SO4 + H2O
В 160
9 Докажите на основании следующего уравнения закон сохранения массы веществ
Na2CO3 + H2O NaHCO3 + NaOH
Е 124
10 Докажите на основании следующего уравнения закон сохранения массы веществ
6KOH+ P2O5 2K3PO4 + 3H2O
В 478
11 Докажите на основании следующего уравнения закон сохранения массы веществ
2Cu(OH)2 + H2SO4 (CuOH)2SO4 + 2H2O
D 294
12 Докажите на основании следующего уравнения закон сохранения массы веществ
2NaOH + CO2 H2O + Na2CO3
Е 124
13 Докажите на основании следующего уравнения закон сохранения массы веществ
FeCl3 + 3NaOH 3NaCl + Fe(OH) 3
Е 282,5
14 Докажите на основании следующего уравнения закон сохранения массы веществ
NaH2PO4 + 2NaOH Na3PO4 + 2H2O
D 200
15 Докажите на основании следующего уравнения закон сохранения массы веществ
Al2О3 + 2NaOH 2NaAlО2+ H2O
В 182
16 Докажите на основании следующего уравнения закон сохранения массы веществ
H3PO4 + 3NaOH Na3PО4+ 3H2O
D 218
17 Докажите на основании следующего уравнения закон сохранения массы веществ
P2O5 + 3H2O 2H3PО4
D 196
18 Докажите на основании следующего уравнения закон сохранения массы веществ
CuCl2 + 2NaOH Cu(OH)2+ 2NaCl
С 215
19 Докажите на основании следующего уравнения закон сохранения массы веществ
3HNO3 + Fe(OH)3 Fe(NО3)3 + 3H2O
В 296
20 Докажите на основании следующего уравнения закон сохранения массы веществ
2HNO3 + Ca(OH)2 Ca(NО3)2+ 2H2O
D 200
21 Докажите на основании следующего уравнения закон сохранения массы веществ
Cu + 2H2SO4(конц.) CuSО4+ SO2 + 2H2O
В 260
22 Докажите на основании следующего уравнения закон сохранения массы веществ
H2SO4 + BaCl2 BaSО4+ 2HCl
С 306
23 Докажите на основании следующего уравнения закон сохранения массы веществ
2HСl + Na2CO3 2NaCl + H2O + CO2
В 179
24 Докажите на основании следующего уравнения закон сохранения массы веществ
H2SO4 + Na2S Na2SО4+ H2S
В 176
25 Докажите на основании следующего уравнения закон сохранения массы веществ
2NH4Cl + Ca(OH)2 CaCl2 + 2H2O + 2NH3
С 181
ТЕМА 4 Закон кратных отношений и Закон постоянства состава
1.Докажите закон кратных отношений на следующих примерах:Cu2O CuO нет пр. (1:2)
D 2:1
2.Докажите закон кратных отношений на следующих примерах:C3H6 C3H8 C3H4
D 3:4:2
3.Докажите закон кратных отношений на следующих примерах:TiO TiO2
Е 1:2
4.Докажите закон кратных отношений на следующих примерах:MnO MnO2 MnO3
В 1:2:3
5.Докажите закон кратных отношений на следующих примерах:NO NO2
D 1:2
6.Докажите закон кратных отношений на следующих примерах:V2O3 V2O5
В 3:5
7.Докажите закон кратных отношений на следующих примерах:Cu2O Cu2O3
С1:3
8 Определите соотношение количества вещества (моль) элементов в серной кислоте
Е 2:1:4
9 Определите соотношение количества вещества (моль) элементов в гидрокарбонате натрия
Е 1:1:1:3
10 Определите соотношение количества вещества (моль) элементов в ортофосфорной кислоте
С) 3:1:4
11 Определите соотношение количества вещества (моль) элементов в гидроксиде железа (III)
С 1:3:3
12 Определите соотношение количества вещества (моль) элементов в сульфате натрия
Е 2:1:4
13 Определите соотношение количества вещества (моль) элементов в гидрофосфате натрия
В 2:1:1:4
14 Определите соотношение количества вещества (моль) элементов в сульфате кальция
А 1:1:4
15 Определите соотношение количества вещества (моль) элементов в дигидрофосфате калия
С1:2:1:4
16 Определите соотношение количества вещества (моль) элементов в сульфате магния
С 1:1:4
17 Докажите закон кратных отношений на следующих примерах: As2O3 As2O5
D 3:5
18 Докажите закон кратных отношений на следующих примерах: CO CO2
Е 1:2
19 Докажите закон кратных отношений на следующих примерах: PbO PbO2
Е 1:2
20 Докажите закон кратных отношений на следующих примерах:Cl2O Cl2O7
С 1:7
21 Докажите закон кратных отношений на следующих примерах: Tl2O Tl2O3
С 1:3
22 Определите соотношение количества вещества (моль) элементов в нитрате натрия
С 1:1:3
23 Определите соотношение количества вещества (моль) элементов в угольной кислоте
В 2:1:3:
24 Определите соотношение количества вещества (моль) элементов в кремниевой кислоте
: В 2:1:3:
25 Определите соотношение количества вещества (моль) элементов в гидроксиде хрома(III)
А 1:3:3:
ТЕМА 5 Закон объемных отношений
1 Докажите на основании следующего уравнения закон объемных отношений:
H2 + O2 H2O
С 2:1:2
2 Докажите на основании следующего уравнения закон объемных отношений
C2H4 + O2 CO2 + H2O
А 1:3:2:2
3 Докажите на основании следующего уравнения закон объемных отношений
H2S + O2 SO2 + H2O(с)
D 2:3:2
4 Докажите на основании уравнения закон объемных отношений:H2 + Сl2 HCl
D 1:1:2
5 Докажите на основании уравнения закон объемных отношений: NO + O2 NO2
D 2:1:2
6 Докажите на основании уравнения закон объемных отношений
C3H8 + O2 CO2+H2O
С 1:5:3:4
7 Докажите на основании следующего уравнения закон объемных отношений
CH4 + O2 CO2 + H2 O
Е 1:2:1:2
8 Докажите на основании следующего уравнения закон объемных отношений
C4H10 + O2 CO2 + H2 O
С 2:13:8:10
9 Докажите на основании следующего уравнения закон объемных отношений
SO2 + O2 SO3
Е. 2:1:2
10 Докажите на основании следующего уравнения закон объемных отношений
C3H6 + O2 CO2 + H2O
С 2:9:6:6;
11 Докажите на основании следующего уравнения закон объемных отношений:
N2 + H2 NH3
Е 1:3:2
12 Докажите на основании следующего уравнения закон объемных отношений
CO + O2 CO2
Е 2:1:2
13 Докажите на основании следующего уравнения закон объемных отношений
NH3 + O2 NO + H2 O
Е 4:5:4:6
14 Докажите на основании следующего уравнения закон объемных отношений
C2H2 + O2 CO2+ H2 O
D 2:5:4:2
15 Докажите на основании следующего уравнения закон объемных отношений
NH3+ O2 N2+ H2 O
D 4:3:2:6
16 Докажите на основании следующего уравнения закон объемных отношений
С3H4 + O2 СО2 + H2 O
С 1:4:3:2
17 Докажите на основании следующего уравнения закон объемных отношений
H2+ I2 HI
D 1:1:2
18 Докажите на основании следующего уравнения закон объемных отношений
NO + H2 N2 + H2O
В 2:2:1:2
19 Докажите на основании следующего уравнения закон объемных отношений
N2 + O2 NO
D 1:1:2
20 Докажите на основании следующего уравнения закон объемных отношений
NO + Cl2 NOCl
D 2:1:2
21 Докажите на основании следующего уравнения закон объемных отношений
CO2 + CH4 CO + H2
D 1:1:2:2
22 Докажите на основании уравнения закон объемных отношений:H2 + Br2 HBr
D 1:1:2
23 Докажите на основании уравнения закон объемных отношений:F2 + O2 OF2
D 2:1:2
24 Докажите на основании уравнения закон объемных отношений: Сl2 + O2 ClO2
D 1:2:2
25 Докажите на основании уравнения закон объемных отношений:C2H2 + H2 C2H6
В 1:2:1
ТЕМА 6 Периодический закон и периодическая система химических элементов
1 Электронная формула валентных электронов элемента имеет вид … 5s24d4. Указать число электронов в наружном уровне.
С 2
2 Могут ли существовать в атоме два электрона с одинаковым набором всех четырех квантовых чисел?
А не могут
3 Какой уровень заполняется после подуровня 4d?
C 5p
4 Определить формулу валентных электронов элемента титана 
А 4s23d2
5 Определить формулу валентных электронов элемента (радия) Ra
В 7s2
6 Среди приведенных ниже электронных конфигураций указать невозможную.
Е 2d2
7 Формула валентных электронов имеет вид: 4s23d3. Определить какой это элемент.
В 
8 У какого элемента начинается заполнение подуровня 4d?
С 
9 Определить формулу валентных электронов элемента марганца 
А 4s23d5
10 Формула валентных электронов имеет вид: 3s23p2. Определить какой это элемент.
А 
11 Формула валентных электронов имеет вид: 4s23d104р6. Определить какой это элемент.
D 
12 Какой подуровень заполняется после подуровня 4s?
В 3d
13 Какой подуровень заполняется в атомах после заполнения подуровня 5р?
E 6s
14 Какую максимальную валентность проявляют элементы VI A группы (A- главная подгруппа)?
D 6
15 Укажите электронную формулу валентного электронного слоя элемента теллур (Te)
Е 5s25p4
16 Электронная формула элемента имеет вид: 1s22s22p63s23p64s23d7. Какой это элемент?
С 
17 Электронная структура атома элемента выражается формулой: 4s23d3. Определить какой это элемент.
В 
18 Среди приведенных ниже электронных конфигураций указать невозможную.
E 3p8
19 У какого элемента заканчивается заполнение подуровня 3d?
А 
20 Среди приведенных ниже электронных конфигураций указать невозможную.
B 2f2
21 Электронная формула элемента имеет вид: 1s22s22p63s23p64s23d104р5. Какой это элемент?
D 
22 Определите электронную формулу валентного энергетического слоя атома сурьмы (Sb)
C 5s25p3
23 Определить формулу валентных электронов элемента ниобия (Nb)
А 5s24d3
24 Определить формулу валентных электронов элемента селена (Se)
С 4s24p4
25 Определить формулу валентных электронов элемента иридия (Ir)
С 6s25d7
ТЕМА 7 Строение атома
1 Сколько неспаренных электронов содержат атомы  в невозбужденном состоянии?
в невозбужденном состоянии?
В
2 Какому элементу соответствует электронная формула валентных электронов… 5s24d5 ?
E 
3 Какой подуровень заполняется перед подуровнем 6s?
D 5p
4 Какому элементу соответствует электронная формула валентных электронов: 5s24d1.
А 
5 Какую максимальную валентность проявляют элементы VI В группы (В – побочная подгруппа)?
D 6
6 Какую максимальную валентность проявляют элементы III A группы (A – главная подгруппа)?
А 3
7 Какую валентность проявляют элементы IVA группы (A – главная подгруппа)?
D 4
8 Сколько максимально электронов может содержать атом на 4 энергетическом уровне?
D 32
9 Изотопы элемента различаются по ………
Дата добавления: 2015-01-01; просмотров: 406; Мы поможем в написании вашей работы!; Нарушение авторских прав |