Шоғырланған (координациялық) байланыстарды талдаңыз
Координациялық байланыс, донорлы-акцепторлы байланыс – кешенді қосылыстарға тән химиялық байланыс түрі. Бөлшектердің біреуі донор, ал басқасыэлектрондар жұбының акцепторы болады. Акцептор деп бос деңгейі (орбитасы) мен оң заряды болатын,молекулалық (атомдық) жүйені айтады. Электрондар жұбы бос (бөлінбеген) жүйе донор деп аталады. Координациялық байланыс түзілгенде бөлінбеген электрондар жұбы донор мен акцептор үшін ортақ болады.
Оның табиғатын түсіндіретін үш теория бар: валенттік байланыс, молекулалық орбиталь және кристалдық өріс.
Алғашқы екеуі Координациялық байланысты коваленттік байланыстың бір түрі деп қарастырса, үшіншісі электрстатикалық әсерлесу күші деп есептейді.
Кешенді қосылыстардағы химиялық байланыс теориялары.Кешенді қосылыстардың түзілуі мен қасиеттерін түсіндіретін 3 теория бар: олар валенттік байланыс теориясы, кристалдық өріс теориясы, молекулалық орбитальдар теориясы.
Алғашқы квантмеханикалық тұрғыдан зерделейтін валенттік байланыс теориясы бойынша кешентүзуші орталық атом мен лиганд өзара донорлы-акцепторлы жолмен байланысады. Көбіне кешентүзуші байланыс түзуге өзінің бос орбитальдарын пайдаланады, ал лиганд болса жұмсалмаған электрон жұбын, яғни қос электронды дайын орбиталын қолданады. Бұл жағдайда кешентүзуші атом не ион – акцептор, ал лигандтар – донор функциясын атқарады.
Сутек катионы мен аммиак молекулаларының арасындағы түзілетін гибридті байланысты ұяшықтар арқылы бейнелесе:
NH3+H+ ®NH 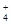
|
| | химиялық байланыстың гибридті орбитальдары
|
2s 2p
|
Енді d-орбитальдары қатынасатын гибридті байланыс түзетін Со3+ионы мен аммиактың кешенді қосылыс түзуін қарастырайық:
Со3+ + 6NH3 ®[Co(NH3)6]3+
Кобальт катионының валенттік электрондарының конфигура-циясы мен квант ұяшықтарда орналасуы мынадай:
Кобальт ионының 4 бос орбиталі 6 лиганд молекуласымен байланысу үшін гибридтенуге мәжбүр, яғни 3d орбитальдағы жалқы электрондар өзара жұптасып, тағы 2 донорлы-акцепторлы байланыс түзуге мүмкіндік туғызады:
| (Со3+)* 3d64s04p0
|
| |
| 3d 4s 4p
| (* - белгісі ионның қозған күйде екенін білдіреді)
Кобальт ионының d2sp3 бос гибридті орбитальдарымен 6 аммиак молекуласының құрамындағы азот атомдарының екі электронды орбитальдары жұптасқанда кешенді катион түзіледі. Оның кеңістіктегі пішіні октаэдрге айналады.
Валенттік байланыс теориясының талаптарына сай түзілетін кешенді иондардың координациялық құрылысы мен кеңістіктегі пішінін орталық атом мен лигандтар өзара донорлы-акцепторлы байланысқанда пайдаланатын орбитальдардың типтеріне сәйкес айқындауға болады. Егер кешентүзуші кординациялық байланыс түзуге sp гибридті 2 орбиталін пайдаланса сызықтық, sp2 гибридті 3 орбиталін қолданса жазық үшбұрышты, sp3 гибридті 4 орбиталі жұмсалса тетраэдрлік, ал dsp2 гибридті 4 орбиталь болса шаршы, dsp3 гибридті 5 орбиталінен үшбұрышты бипирамида, d2sp3 гибридті 6 орбитальдан октаэдр пішінді кешендер түзіледі.
Валенттік байланыс теориясы кешенді қосылыстардың түзілу механизмі мен кеңістіктік пішінін анықтаумен шектелмейді, ол магниттік қасиеттерін де анықтап бере алады. Мысалы, қарастырылған кобальттың аммин кешенді катионының байланысқа түскен орбитальдары түгелдей қос электронды конфигурацияға ие болатындықтан оның жалқы электрондары жоқ, демек ол диамагнитті. Егер осыған сырттай ұқсас фторокешенді алсақ ол парамагнитті болып шығады. Мұндай ерекшелікті түсіну үшін [CоF6]3- анионының түзілуін қарастырайық. Тәжірибелік деректерден фторокешендегі Со3+ ионының 3d орбитальдары қалыпты күйін сақтап өзгеріссіз қалады. Тағы да 2 донорлы-акцепторлы байланыс түзу үшін кобальт ионы сыртқы қабаттағы бос тұрған 4d деңгейшесіндегі 2 орбитальді пайдаланады. Сөйтіп кешенді анионның кеңістіктегі пішіні sp3d2 гибридке сәйкес октаэдрлік типке жатады.
Енді осы мысалға алған 2 кешен түзетін иондардың бірінен бірінің айырмашылығының мәнін түсінейік. Аммин кешенде кобальт катионы байланыс түзуге ішкі d-орбитальды, ал фторокешенде сыртқы d – орбитальды қолданды. Мұндай кешентүзушінің «ішкі орбитальды», сыртқы d-орбитальдардың қатынасуы мен түзілетіндері «сыртқы орбитальды» деп жіктеледі. Ішкі орбитальды кешендер түзілгенінде жалқы электрондардың саны аз болатындықтан оларды «аз спинді кешендер» деп атайды. Сыртқы орбитальды кешендердегі жалқы электрондар саны көп болады, оларды «көп спинді кешендер» деп саралайды. Ішкі және сыртқы орбитальді кешендердің бұлайша екіге бөлінуі олардың құрамына кіретін лигандтар табиғатына тәуелді.
|