
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Ерітінділердегі тепе-теңдіктерді негіздеңіз
Сыртқы жағдайы өзгермейтін болса тепе-теңдікте тұрған жүйе ұзақ уақыт бойы өзгермей қала берер еді. Сыртқы жағдайдың өзгеруі жүйедегі тепе-теңдіктің бұзылуына, сөйтіп, тіке не кері реакцияның бірінің шапшаңдап жүре бастауына әкеп соғады. Әдетте, тепе-теңдікті өзгерте алатын дәйектерге — концентрация, қысым, температура жатады. Осылардың әсерінен тепе-теңдіктің бұзылуын тепе-теңдіктің ығысуы не аууы деп атайды.
Әр дәйектің тепе-теңдікке тигізетін әсерін жеке қараймыз. Химиялық тепе-теңдіктің тууына мысал ретінде алған реакция – йод сутектің түзілуін қарастырайық:
Н2 + І2«2НІ
Жүйеге сырттан қосымша Н2 енгізді делік. Кинетиканың негізгі заңы бойынша бастапқы заттардың бірінің мөлшері артқандықтан тіке реакцияның жылдамдығы артады. Осының нәтижесінде жаңа НІ молекулалары түзіліп, Н2 мен І2 концентрациялары кеміп, ақыры сол температурада тағы да жаңа тепе-теңдік туады. Онда НІ мөлшері бұрынғымен салыстырғанда артатынын, ал І2 кемитінін білу қиын емес.
Химиялық тепе-теңдікті ығыстыру үшін реакциядағы кез келген заттардың концентрациясын арттырып не кемітіп өзгерте беруге болады. Олардың әрбірінің өзгеруіне сай химиялық тепе-теңдіктің ығысу бағытын анықтау оңай. Егер тепе-теңдік күйде тұрған жүйеде тіке реакцияға қатысатын реагенттердің концентрациясын арттырса, тепе-теңдік сол заттар өзара әрекеттесетін бағытта, яғни оңға қарай ауады. Керісінше, олардың мөлшерін азайтса, тепе-теңдік реакция өнімдерінің әрекеттесу бағытында, яғни солға қарай ығысады. Газ күйіндегі азот пен сутектен жоғары температурада өршіткі қатысуымен реакцияласқанда аммиак түзілетінін, әрі бұл үдерістің нәтижесінде сыртқа жылу бөлінетінін ескеріп, тепе-теңдікте тұрған жүйені өрнектесе:
N2 + 3Н2«2NH3 + Q
Осы жүйеге әуелі қысымның, содан соң температураның әсерін бақылайық.
Алдымен температураны өзгертпей тұрып жүйедегі қысымды екі есе арттырайық. Алғашқы сәтте жүйедегі барлық газдардың парциалды қысымы 2 есе жоғарылайды, сондықтан екі бағыттағы реакция да шапшаң жүре бастайды. Алайда тіке және кері реакцияның жылдамдықтары бірдей өспейді. Бастапқы тепе-теңдік күйдегі қайтымды реакцияның жылдамдықтары
υт = кт×РN 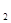 ×Р3Н
×Р3Н 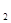
υк = кк× Р2NН 
болады. Кейін қысым 2 есе жоғарылап, жаңа тепе-теңдікке келгендегі реакция жылдамдықтары мынадай:
υ1т=кт×2РN 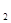 (2РН
(2РН  )3= 16×кт×РN
)3= 16×кт×РN 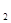 ×Р3Н
×Р3Н  = 16υт
= 16υт
υ1к= кк× (2РNН  )2= 4 кк× Р2NН
)2= 4 кк× Р2NН  =4 υк
=4 υк
Бұдан тіке реакцияның жылдамдығыкері реакцияға қарағанда 16:4 = 4 есе шапшаңырақ болып, жүйедегі аммиак мөлшері, яки қысымы арта бастайды, өйткені тепе-теңдік оңға қарай ығысады.
Тіке және кері реакцияның жылдамдықтарының әр түрлі өзгеруінің сыры – қайтымды үдеріске қатысқан реагенттер мен өнімдердің газ күйіндегі моль сандарының бірдей болмауымен түсіндіріледі. Шынында реакция теңдеуі бойынша алғанда бастапқы 4 моль газдан 2 моль аммиак түзіледі, сондықтан қысым артқанда реагенттердің өзара соқтығысуы түзілген аммиак молекулаларының түйісуінен әлдеқайда мол болады. Осыдан барып. тепе-теңдік оңға қарай, газдың моль саны азаятын бағытта ығысып, жүйенің жалпы қысымын кемітеді. Ығысу жүйеде жаңа тепе-теңдік орнағанға дейін жүреді.
Тепе-теңдікке қысымның әсерін жалпы былай қорытындылауға болады: тепе-теңдікте тұрған газдардың қысымын арттырғанда ол моль саны азаятын бағытта, яки қысымның кему бағытына ауады; керісінше, қысым кемісе, тепе-теңдік газдың моль санының арту, яғни қысымды жоғарылату бағытына қарай ауады.
Егер реакцияға қатысатын және одан шығатын газдардың моль саны өзара тең болса, қысымды өзгерткенмен тепе-теңдік бұзылмайды, өйткені екі бағыттағы үдерістің де жылдамдығы бірдей өзгереді. Оған жоғарыдағы йод сутектің түзілу жүйесі мысал бола алады.
Тепе-теңдікте түрған жүйенің заттарын қыздыру, не суыту тепе-теңдіктің ығысуына әкеледі. Оған жауапты реакцияда бөлінетін не сіңірілетін жылу мөлшері болып табылады. Температураны жоғарылатқанда тепе-теңдік сол жылуды сіңіретін эндотермиялық реакция бағытына қарай ығысады, төмендеткенде, керісінше, жылу шығаратын экзотермиялық реакция бағытына ауады. Аммиактың түзілуі экзотермиялық реакция қатарына жатады. Олай болса, берілген жағдайда ортаның қызуының жоғарылауы түзілген аммиактың көбірек ыдырап, кері реакцияның шапшаңдауыңа, яғни тепе-теңдіктің солға қарай аууына әкеледі. Ортаның қызуының темендеуі тепе -теңдікті тіке бағытта ығыстырады, аммиак молырақ түзіле бастайды.
Қарастырылып өткен үш түрлі мысалдың бәрінде де жүйенің жағдайының өзгеруінен тепе-теңдіктің ығысуы жалпы бір ережеге - Ле – Шателье ұстанымына бағынады: химиялық тепе-теңдік күйіне келіп тұрған жүйенің жағдайының (температура, концентрация, қысым) бірін өзгерту тепе-теңдікті сол өзгертуге қарсы әрекет жасайтын реакция бағытына қарай ығыстырады.
Шынында да жүйеге бір зат енгізіп оның концентрациясын арттыра бастағанда тепе-теңдік сол затты жұмсап, азайту бағытында ығысты. Қысымды жоғарылатқанда тепе-теңдік жүйенің өз ішінде қысымды кемітетін бағытқа қарай ауды. Қызудың күшеюі тепе-теңдіктегі реакцияны жылу сіңіріп, сол келген қызуды темендететін бағытқа қарай ығыстырды. Сондықтан Ле Шателье ұстанымын (1887 ж. ұсынылған) әсерге қарсы әсер ұстанымы деп атайды.
Біз тепе-теңдікке үш түрлі басты фактордың әсерін жеке-жеке қарастырдық. Іс жүзінде олардың екеуінің не үшеуінің бірдей келуі мүмкін. Сонда да әрбірінің әсерін Ле Шателье ұстанымы бойынша біле отырып, жалпы әсерді де болжауға болады. Тепе-теңдікті ығыстырудың бағытын күні бұрын біліп, реакцияға қолданудың химия ғылымы мен өнеркәсібі үшін үлкен маңызы бар. Мәселен, жоғарыда келтірген аммиактың түзілуі дәл сондай тікелей синтез жолымен өндірісте іске асатыны мәлім. Егер аммиак өндірісінің қуатын арттырып, оны алуды тездету қажет болса, қысымды жоғарылатып, бастапқы реагенттер-азот пен сутектің ағынын күшейту (концентрацияны молайтқанмен пара-пар) қажеттігін теория жүзінде айтуға болады. Өршіткі мен жоғары температура (тепе-теңдікті кері ығыстыратынына қарамастан) реакцияның жылдамдығын арттыру үшін қолданылады.
Ле Шателье ұстанымы тек химияға қатысты емес, бүкіл физикалық, физика-химиялық үдерістердің бәріне де толығымен қолданылады. Мысалы, булану, кристалдану, еру т. б. құбылыстардың тепе-теңдікте тұрған күйін ығыстыру осы ережеге сай жүргізіледі.
Ле Шателье ұстанымы бұдан кейінгі тақырыпшаларда қаралатын термодинамиканың екінші бастамасына сай келіп, тепе-теңдік күйді сипаттайды
Еру кезіндегі тепе-теңдік. Еру және кристалдану үдерістерінің жылдамдықтары теңескенде тепе-теңдік орнайды:
υк = кк
ке•S = кк•S•[J2].
Соңғы теңдіктің екі жағын да кк - ға бөлсе:
=[J2]
ке мен кк температураға тәуелді болғандықтан олардың қатынасы да температураға тәуелді. Бірақ, температура тұрақты болғанда бұл константалар және олардың қатынасы тұрақты шама. Сондықтан былай жазуға болады.
[J2] = = К=const
өрнектен тепе-теңдік кезінде ерітіндідегі йод концентрациясының тұрақты болатыны көрінеді. Сонымен қанық ерітіндінің (тепе-теңдік күйдегі ерітіндінің) концентрациясы, яғни заттың ерігіштігі еру кезіндегі тепе-теңдіктің константасы болып табылады. Оның шамасы еру үдерісінің қаншалықты терең жүретінін сипаттайды.
Дата добавления: 2015-01-01; просмотров: 746; Мы поможем в написании вашей работы!; Нарушение авторских прав |