
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Ышқылдар мен негіздер теориялары. Қышқылдық негіздік электрондық теориясын талдаңыз.
Қышқылдар жайлы алғашқы теориялар.Қышқылдардың табиғатын теория жүзінде айыра білу Лавуазьенің еңбектерімен байланысты. Ол көптеген қышқыл-дар жай заттардың оттекпен әрекеттесуінен шығатынын байқады. Мәселен, күкірт пен фосфордың оттекті қосылыстары- оксидтердің судағы ерітінділері қышқылдық қасиет - көрсететіндігі анықталды. Қышқылдарға тән ортақ қасиет - олардың құрамында оттек бар заттардың бәрі де қышқыл болады деген ұғым қалыптасты. Оттектің аты оксигениум француздың “oxygene” - "қышқыл тудырушы" деген сөзінен шыққан.
Лавуазье теориясы біршама қышқылдардың, тұздардың түзілуін түсіндіре білді. Лавуазье теориясынан туатын қышқылдарды бөліп оттекті қышқылдар деп атауды ұсынды.
Қышқыл мен негіздің иондық теориясы. Иондық теория бойынша қышқыл деп суда ерігенде сутек ионын Н+ бөлетін заттарды айтады, өйткені қышқылдарға тән жалпы қасиеттер-металдарға, индикаторларға әсері, дәмі, т.т. тек сутек катионының қасиеті болып табылады. Негіздер деп суда гидроксид ионын ОН- бөлетін заттарды айтады. Олардың жалпы қасиеттері: қышқылдық табиғатты заттарға, индикаторларға әсері, денеге тигенде сабындануы т.т. бәрі де тек гидроксид анионына тән қасиеттер.
Қышқыл мен негіздің өзара бейтараптану реакциясының теңдеуі:
H+ + OH- = H2O
Бұдан қышқылдың немесе негіздің күшін білу үшін ерітіндідегі Н+ және ОН- иондарының концентрациясын анықтау жеткілікті болатыны көрініп тұр. Шынында да осыдан барып қышқылдар мен негіздердің басты сипаттамалары: диссоциациялану константасы, сутектік көрсеткіш рН шықты. Қышқылдар мен негіздердің иондық теориясының арқасында бүтіндей суда жүретін үдерістердің аквахимиясының негізі қалыптасты.
Оның қарамағында бір ғана қышқыл Н+, бір ғана негіз ОН- бар. Сондықтан бейтараптану реакциясы да жалғыз, әрі оның негізінде тұз түзілудің орнына су түзіліп тұр. Су - қышқыл мен негіздің бірін - бірі толығымен бейтараптануынан шығатын-дықтан дүниедегі бірден-бір абсолют бейтарап зат болып есептеледі.
Сольвожүйелер теориясы.Аррениус ұсынған қышқылдар мен негіздердің моделінің әлсіз жері қышқылдық-негіздік әрекеттесулерді тек сулы ерітінділерде қарап шектеуі болды. Еріткіш ретінде басқа сұйықтықтар алынғанда иондық теория түсіндіре алмайтын жайттардің беті ашылды. Алайда суда жүретін үдеріс пен бейсулы еріткіште жүретін үдерістің арасында үлкен ұқсастық бар екендігі байқалды. Мұны алғаш байқаған америкалық ғалым Франклин өзінің сольвожүйелер теориясын ұсынды.
Судың диссоциациялануына сай аквохимия негізі қаланып, заңдары белгіленсе, дәл осыған ұқсатып сұйық аммиактың диссоциациялануын жазып:
2H2O = H3O+ + OH-
2NH3 = NH 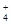 + NH
+ NH 
аммонохимия негіздерін салуға болады.
Сулы ортада оксоний Н3О+ катионын түзетін заттар қышқылдар болса, сұйық аммиакта аммоний NH+4 катионын бөле диссоциацияланатын заттар қышқылдық қасиет көрсетуі тиіс. Сол сияқты судағы гидроксид ОН- аниондарының орнына аммиакта NH-2 амид аниондары жүретіндіктен KNH2 тәрізді заттар негіздерге жатады.
Сольвожүйелер теориясында қышқылдар деп диссоциацияланған кезде еріткіштің өзі түзетін оң ионға ұқсас катион - лиат беретін заттарды, негіздер деп диссоциация-ланғанда еріткіштің өзі түзетін теріс ионға ұқсайтын анион- лионий бөлетін заттарды айтады.
Протондық теория.Иондық және сольвожүйелер теориясын сипаттағанда табиғаттағы ешбір затты ерекше етіп қарауға болмайды деген пікір айтылды. Алайда химиялық реакцияларға қатысатын бір бөлшектің бойында оқшау ерекше қасиеттердің болатынын айтпай кетуге болмайды. Ол бөлшек протон - сыртында электрон қауызы жоқ жалғыз ион.
Протондық теория бойынша сутек катионы Н+ қатысқан реакциялар протолитті реакциялар деп бөлінеді. Теория бойынша өзінен протон бөле алатын бөлшек (молекула не ион) қышқыл, ал протон қосып ала алатын бөлшек негіз деп саналады.
Сулы ерітіндіде Н+ бөлетін молекуланың протондық теория тұрғысынан алғанда да қышқыл болып шығатыны даусыз. Бірақ ол зат еріткіш болмағанда да не судан басқа еріткіште де өзінен протон бөлетіндей қабілеті болса қышқылдар қатарында қала береді. Мәселен, иондық теория бойынша HCl газын суда ерігенде ғана қышқыл деп санасақ, протондық теория оны сусыз - ақ қышқыл деп таниды. Міне осының өзінен соңғы теориядағы қышқылдың анықтамасы бұрынғымен салыстырғанда әлдеқайда кең екендігі көрінеді.
Протолиттік реакцияның мысалы ретінде хлорсутектің суда еруін алайық:

 HCl + H2O H3O+ + Cl-
HCl + H2O H3O+ + Cl-
HCl өзінен протон бөліп қышқылдық қасиет көрсетсе, Н2О оны қосып алып негіз ролін атқарады. Бұл реакция негізінен бір бағытта солдан оңға қарай жүретіні мәлім.
Электрондық теория. Америкалық ғалым Дж. Льюис ұсынған қышқылдық-негіздік әрекеттесудің электрондық теориясы.
Электрондық теория бойынша негіз деп химиялық байланыс түзуге электрон қосағын беретін донор атомы бар затты, ал қышқыл деп сол электрон жұбын қабылдайтын акцептор атомы бар затты айтады. Қышқылдық - негіздік әрекеттесу, түптеп келгенде, электрон қосағының донордан акцепторға ауысып, ортақ ковалентті байланыс түзуімен түсіндіріледі. Олай болса, электрондық теория бойынша қышқылдық-негіздік реакцияларға донорлы-акцепторлы байланыс түзетін әрекеттесулердің бәрі де жатады. Мысалы:

 : NH3 + BF3 NH3 : BF3
: NH3 + BF3 NH3 : BF3
донор - негіз аммиакты акцептор - қышқыл бор фториді бейтараптайды. Бұл реакция протондық теория негізінде түсіндіріле алмайды. Шындығында аммиакты бор фторидімен индикатор қатысуында бейтараптауға болады.
Электрондық теорияның жетімсіздіктері де, кемшіліктері HCl, H2SO4 тәрізді қышқылдардың қышқылдық қасиетін дәлелдей алмайды, үйткені олардың құрамында электрон жұбы жетпей тұрған атомдар жоқ, сондықтан олар өзіне электрон қосағын қосып ала алмайды. Электрондық теория сутекті қышқылдардың ішінен тек электрон жұбы жетімсіз аз ғана заттарды (Н3ВО3, Al(OH)3) қышқылдар қатарына жатқызады.
Қышқылдар мен негіздердің жалпылама теориясы.Бұл теория қышқылдық-негіздік қасиеттерді жоғарыда келтірілген теориялардың бәрінен кеңірек қамтиды. Оның ең басты сипаттамасы - қышқылдық-негіздік әрекеттесудің нәтижесінде тұз түзілуі тиіс деп санайды. Тұз - қышқыл мен негіздің өзара бейтараптануынан шығатын өнім.
Бұл теория бойынша қышқыл дегеніміз өзінен катиондар (оған протон да кіреді) бөле алатын немесе аниондар (оған электрон да кіреді) қосып ала алатын бөлшек. Бұл анықтамаға бұрынғы теорияларға сай келетін сутекті, сутексіз қышқылдардың бәрі де бағынады. Негіздер - керісінше аниондар (электрондар) беруге немесе катиондар (протондар) қосып алуға бейім бөлшектер.
Теория тұз түзе жүретін барлық реакцияларды бейтараптау үдерісі ретінде қарайды. Тұздың өзі қышқыл - катион мен негіз анионнан тұрады. Тұз ретінде кез келген электролит (тіпті әлсіздері де) қабылданады. Бұл күрделі теорияға бағынатын қышқылдық - негіздік әрекеттесулерге бірнеше мысалдар келтірейік.
Су мен күкірт (VI) оксиді әрекеттескенде:
2H2O + SO3 = H3O+ + SO 
су өзінен анион О2- бөліп негіздік қасиет көрсетсе, күкірт (VI) оксиді осы анионды қосып алып, қышқылдық қабілетін танытады. Егер судың орнына натрий оксиді алынса да тұз түзіледі:
Na2O + SO3 = 2Na+ + SO 
Мұндағы натрий сульфаты басқа тұздар сияқты қышқыл (Na+) мен негізден (SO42-) құралғанымен бұл реакция бейтараптану реакциясына жатады, өйткені бастапқы күшті негіз Na2O мен күшті қышқыл SO3 әрекеттескенде әлсіз негіз SO42- және әлсіз қышқыл Na+ шығады.
Дата добавления: 2015-01-01; просмотров: 2423; Мы поможем в написании вашей работы!; Нарушение авторских прав |